人類物種在生物學上的特點是生育率低。事實上,在每個月經周期中,一對處於生殖能力高峰期的夫婦只有大約 30% 的受孕機會。世界衛生組織指出,不孕症是「一種生殖系統疾病,定義為在定期無保護12個月或更長時間後未能實現臨床妊娠。輔助生殖技術(ART)包括所有治療或程序,包括體外處理人類卵母細胞和精子或胚胎,以建立懷孕。
這些技術通常分為三大類:
-
一級技術:宮內和宮頸內人工授精(IUI / ICI),更簡單,侵入性較小的人工授精(IUI),例如宮內人工授精(IUI)伴或不伴宮頸內人工授精(ICI)卵巢刺激。
-
二級技術:可以在局部麻醉或深度鎮靜下進行的更複雜和更具侵入性的技術,與基本技術不同,因為它們涉及對雌性和雄性配子的操作,並且因為它們需要體外受精。在這些技術中,IVF(體外受精和胚胎移植),ICSI(卵胞漿內單精子注射)以及雄性和雌性配子和胚胎的可能冷凍保存。
-
需要全身麻醉插管的三級技術程序,包括:
-
腹腔鏡取卵,腹腔鏡下雄性和雌性配子(GIFT),受精卵(ZIFT)和/或胚胎(TET)的輸卵管內移植;
-
睪丸配子的顯微外科取樣:睪丸精子提取(TESE),顯微外科睪丸精子提取(microTESE),睪丸精子抽吸(TESA);
-
附睪配子的顯微外科取樣:經皮附睪精子抽吸術(PESA)和顯微外科附睪精子抽吸術(MESA)。在所有輔助生殖技術中,接受能夠「體外」誘導獲能的治療,以便處於頂泌體反應閾值的活化精子可以與成熟的卵母細胞相互作用。植入前遺傳學篩查(PGS)和植入前遺傳學診斷(PGD)是高度專業化的程序,涉及從5-6天大的囊胚中取出三到四個細胞,並在將胚胎移植到女性子宮之前測試它們的染色體異常。根據歐洲人類生殖與胚胎學會(ESHRE)的歐洲試管嬰兒監測聯盟(EIM)報告的數據,每次抽吸和每次移植的臨床妊娠率(PR)分別為28.0%和34.8%。在ICSI之後,相應的比率分別為24%和33.5%。抗逆轉錄病毒治療可以減輕個人和家庭的不孕負擔,但它也可能給公共衛生帶來挑戰,抗逆轉錄病毒治療的多胞胎、早產和低出生體重分娩率高就證明了這一點。
-
介紹
人類物種在生物學上的特點是生育率低。
事實上,在每個月經周期中,一對處於生殖能力高峰期的夫婦只有大約 30% 的受孕機會。這個百分比已經相當適度,在存在可能降低生殖能力的因素的情況下顯著降低。世界衛生組織(世衛組織)指出,由每個人和夫婦根據自己的良心決定他們是否打算懷孕,如果是,他們何時希望生孩子,以及確定家庭單位的規模。但是,生育問題可能會影響懷孕的可能性。世界衛生組織指出,不孕症是「一種生殖系統疾病,定義為在12個月或更長時間的定期無保護後未能實現臨床妊娠」 [
1
]據報導,發展中國家四分之一的夫婦受到不孕症的影響。2012年,從20年到1990年的2010年間,女性不孕症保持在類似的範圍內。然而,在2019年,全球不孕症有所增加,因為發現女性的年齡標準化不孕症患病率每年增加0.37%,男性每年增加0.29%。由於很大一部分夫婦在嘗試至少 2 年後設法生了一個孩子,因此許多人更喜歡在 24 個月後談論不孕症。另一方面,術語「亞生育力」表示生育指數低三到四倍:這意味著一些夫婦將不得不等待更長的時間才能懷孕。雖然很難評估各種因素對不孕症原因的影響,但關於不孕症發病率和主要原因的數據在世界範圍內是相似的。大約20-30%的不孕症病例是由於男性不育症,20-35%是由於女性不育症,25-40%是由於兩部分的綜合問題。在10-20%的病例中,沒有找到原因。
女性不孕症的常見促成因素包括:
男性不育的主要原因是精液質量低下。在擁有生育所需生殖器官的男性中,不孕症可能是由於內分泌問題、藥物、輻射或感染導致的精子數量低引起的。可能存在睪丸畸形、激素失衡或男性導管系統阻塞。
男性和女性不育症:在某些情況下,男性和女性都可能不育或生育能力低下,夫妻不孕症是由這些條件的組合引起的。在其他情況下,懷疑原因是。
不明原因導致的不孕症(特發性):在美國,高達20%的不孕夫婦患有未知(不明原因)的不孕症。在這些情況下,可能存在異常,但當前方法無法檢測到。
-
卵巢疾病和荷爾蒙失調(例如多囊卵巢綜合徵 - PCOS)、卵巢早衰 (POF)、下丘腦功能障礙、高催乳素血症。
-
輸卵管損傷(包括既往輸卵管結紮術)。
-
由肺結核等感染引起的盆腔炎性疾病(PID)。
-
與年齡相關的因素。
-
子宮問題(良性息肉肌瘤)。
-
宮頸疾病(良性息肉或腫瘤和宮頸狹窄)。
-
子宮內膜異位。
-
高齡產婦。
-
18,2 輔助生殖技術
輔助生殖技術(ART)包括所有治療或程序,包括體外處理人類卵母細胞和精子或胚胎,以建立懷孕。越來越多的夫婦轉向ART尋求幫助,以懷孕並最終生下自己的健康活嬰兒。1978年2010月,路易絲·布朗(Louise Brown)是母親接受試管嬰兒治療後第一個成功出生的孩子。布朗是自然周期試管嬰兒的結果,沒有受到刺激。手術在英國奧爾德姆Ryton的Kershaw博士小屋醫院(現為Kershaw博士臨終關懷醫院)進行。羅伯特·愛德華茲(Robert G. Edwards)於1978年獲得諾貝爾生理學或醫學獎。生理學家與Patrick Steptoe和胚胎學家Jean Purdy共同開發了這種治療方法,但後兩者沒有資格被考慮,因為他們已經去世,諾貝爾獎不是死後頒發的。自2008年英國體外受精(IVF)後第一個嬰兒出生以來,包括IVF和胚胎移植(ETs)在內的輔助生殖技術(ART)已在全球範圍內廣泛用於不孕症治療。國際輔助生殖技術監測委員會報告說,2010年至<>年期間,超過<>萬嬰兒在抗逆轉錄病毒治療後出生。
-
18,3 藝術技巧和適應症
這些技術通常分為三大類:
在所有輔助生殖技術中,接受能夠「體外」誘導獲能的治療,以便處於頂泌體反應閾值的活化精子可以與成熟的卵母細胞相互作用。
準備工作有兩個目標:
18.3.1 一級技術:宮內和宮頸內人工授精IUI/ICI
宮內人工授精最常用於有以下情況的夫婦:
在IUI周期中,男性伴侶的精子在排卵時準備好並直接放置在子宮中。精子可以在自然周期或卵巢刺激周期中授精。
在自然周期中,授精的時間可以通過測量尿黃體生成素(LH)來確定。LH水平升高的檢測也可以在診所進行,每天使用血液樣本。最後,經陰道超聲聯合給予人絨毛膜促性腺激素(hCG)可用於定時授精[2]。在OH的周期中,女性接受克羅米芬檸檬酸鹽,抗雌激素或促性腺激素,以誘導多達三個卵泡的生長。授精的時間由經陰道超聲結合hCG觸發的排卵確定。
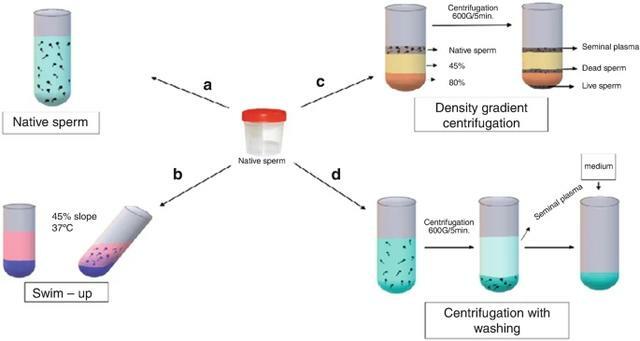
當卵泡估計大小達到15-20mm時,肌內注射人絨毛膜促性腺激素(hCG),從而誘導卵母細胞最終成熟[3]。有許多精子製備程序可用,但有三種主要方法(圖18.1)用於從天然精子中選擇最佳精子(圖18.1a)。
圖 18.1 比較精子製備程序的說明 (a) 天然精子;(b) 游泳;(c) 密度梯度離心,和 (d) 洗滌離心
18.3.1.1 精子製備技術
關於IUI結局,最近的證據表明,與沒有卵巢刺激的期待治療相比,在自然受孕預測評分較低的夫婦中,與沒有卵巢刺激的期待治療相比,使用IUI進行卵巢刺激治療可能會導致更高的活產率。同樣,與在刺激周期中期待治療相比,在自然周期中使用IUI治療可能會導致更高的累積活產率[5]。目前,IUI最重要的適應症是供體精子治療。在這些情況下,精子可以通過宮內人工授精(IUI)或宮頸內授精(ICI)引入。IUI和ICI之間的主要區別在於精子的處理[6]。
18.3.2 二級技術:體外受精(IVF)
生育治療很複雜,每個周期由幾個步驟組成。如果這些步驟之一應用不正確,則可能無法發生受孕。
18.3.2.1 跡象
體外受精適用於無法懷孕的夫婦:
以下步驟構成了試管嬰兒周期:
然後是黃體期支持,有幾種選擇,包括給予黃體酮、雌激素(E2)和人絨毛膜促性腺激素 (hCG)。
最後,不良反應,如卵巢過度刺激綜合徵,可能與輔助生殖過程有關。
18.3.2.2 試管嬰兒中的受控卵巢刺激
受控卵巢刺激包括三個基本要素。
可用的促性腺激素製劑包括人絕經期促性腺激素(hMG),一種具有卵泡刺激素(FSH)和促黃體生成素(LH)活性的泌尿產物,純化的FSH(p-FSH)和高度純化的FSH(hp-FSH),以及各種重組FSH(rFSH)和LH(rFSH/rLH)製劑。此外,一些診所提供無刺激周期的IVF,預期只收集一個成熟的單個卵子,但這種做法尚未得到廣泛確立[7]。
GnRH激動劑或拮抗劑已用於許多不同的方案中。在所謂的「長方案」中,GnRH激動劑在刺激前至少2周開始,並持續到卵母細胞成熟。或者,使用「短方案」,其中GnRH激動劑與刺激同時開始並持續到卵母細胞成熟觸發的那一天。另一種選擇是使用GnRH拮抗劑。與激動劑「長方案」相比,這些涉及更短的使用時間,並且在刺激開始後幾天開始,一直持續到施用藥物以觸發卵母細胞成熟。
18.3.2.3 控制卵巢刺激和卵巢反應
根據卵巢反應,患者分為正常反應者、低反應者和過度反應者。儘管沒有普遍接受的對不良反應者的明確定義,但博洛尼亞分類[8]通過以下兩個特徵來定義不良反應者:
既往有發生OHSS風險的超應答患者包括PCOs、BMI低、AFC計數高、AMH水平升高和血清E2濃度升高[7]。卵巢刺激方案是根據患者的預期反應選擇的。Duiring控制的卵巢刺激,卵泡的數量和大小,在經陰道超聲檢查中可視化,提供卵巢反應的估計,當一定數量的卵泡達到一定大小時,hCG用於觸發排卵。雌二醇由卵泡發育產生,可提供額外的信息,據信可以進一步改善決策過程;卵泡成熟度由足夠的雌二醇水平支持,而在存在非常高水平的情況下,OHSS的風險增加。在試管嬰兒周期的刺激階段結束時,使用藥物觸發最終的卵母細胞成熟,用於模擬自然內源性LH激增並在成熟卵子從女性身上收集並在實驗室中與精子受精之前啟動排卵過程。目前使用兩種藥物:人絨毛膜促性腺激素(HCG),這是最常見的藥物,或拮抗劑方案中的GnRH激動劑。
18.3.3 IVF—ICSI:實驗室階段
體外受精(IVF)和順原體內單精子注射(ICSI)是實驗室技術,都涉及從卵泡中抽吸卵母細胞。因此,在這兩種技術中,患者要進行的治療和取卵是絕對相同的。採用哪種技術是在取卵後「在實驗室」做出的決定。
18.3.3.1 體外受精
IVF包括將精子放置在卵母細胞附近,並讓其中一個自然受精(圖18.2)。當精子具有足夠數量的精子並具有足夠的活力使卵子受精時,可以使用這種技術。
18.3.3.2 順原體內單精子注射 (ICSI)
ICSI體外受精是一種輔助生殖技術,允許通過將單個精子顯微注射到卵母細胞(女性生殖細胞)中來授精。ICSI要求選擇精子並將其注射到卵母細胞中,迫使其受精(圖18.3)。
一旦受精,卵母細胞就會成為前胚胎並轉移到子宮內,以便繼續發育(圖18.4)。
ICSI是常規體外受精的補充工具。之前和隨後的階段與授精(刺激卵巢、卵泡穿刺和胚胎移植)相同;只有授精技術發生了變化。當精子數量非常少並且它們的運動性非常低時,使用這種技術。使用這種技術,可以明顯保存精子:每個卵母細胞只需要一個精子,而在傳統的IVF中,需要50,000到100,000個精子。試管嬰兒技術比ICSI更忠實地再現自然界中可能發生的情況;允許精子以非常自然的方式進入,而不必在卵母細胞壁上產生微創傷(ICSI的顯微注射)。讓卵子受精的精子是「自然選擇的」。然而,我們還不確定這種選擇過程是否比在實驗室中使用ICSI進行的過程更好。由於精子和卵母細胞長時間保持接觸,因此稍微未成熟的卵母細胞即使在拾取數小時後也會發育並受精。另一方面,ICSI技術是唯一可以在精損傷嚴重或必須直接從睪丸而不是射精中取出精子時懷孕的技術。它確保如果存在精子無法「通過」卵壁的問題,可以通過將精子微注射到壁外來克服。如果使用磨砂的卵母細胞,這是使卵母細胞受精的唯一技術。因此,很明顯,在某些情況下,選擇ICSI是一個合適的和強制性的選擇,它徹底改變了輔助生育的世界,允許用非常嚴重受損的受精。同樣,在適用的情況下,試管嬰兒仍然是一種有效且非常成功的技術。因此,不建議使用常規ICSI,而僅在特定情況下使用。因此,將根據夫婦的臨床情況選擇最合適的技術。
18.3.4 第三級技術:無精子症患者的試管嬰兒
精液中沒有精子並不一定意味著它們根本不會產生。在無精子症、隱精子症、壞死精子症和射精的情況下,精子可以在其他部位(睪丸或附睪)中識別,即使數量很少,也可以使用各種技術收集。睪丸精子提取(TESE)和顯微外科睪丸精子提取(microTESE)或睪丸精子抽吸(TESA)允許從睪丸中恢復精子;其他技術如附睪經皮附睪精子抽吸(PESA)和附睪顯微外科附睪精子抽吸(MESA)。詳細的提款主要技術有哪些:
TESE:是睪丸組織的活檢,一種允許從手術切除的睪丸組織的小碎片中恢復精子的程序。TESE可在局部、局部麻醉或深度鎮靜下進行。外科醫生切開覆蓋睪丸的組織(白螂),並取一部分橙子大小的生精小管。去除的片段在無菌試管內輸送給生物學家,用於提取精子。在同一睪丸中採樣可以是單個或多個。還常規進行組織學檢查,以準確診斷無精子症並攔截隱匿性腫瘤形式,這在非阻塞性無精子症中很常見。精子恢復成功率:在阻塞性無精子症(OA)、阻塞性隱精子症、壞死性精子症和射精中,ICSI的「有用」精子恢復率接近100%。在非阻塞性無精子症(NOAs)和分泌性隱無精子症中,「有用」精子的恢復率為50%。通常,它是在對女性伴侶進行卵巢刺激之前進行的,冷凍保存精子,以優化時間並在沒有精子的情況下避免對女性進行激素治療。
18.3.5 遺傳疾病/植入前基因檢測
試管嬰兒的另一個適應症是在植入前對胚胎進行基因檢測。植入前遺傳學篩查(PGS)和植入前遺傳學診斷(PGD)是高度專業化的程序,涉及從5-6天大的囊胚中取出三到四個細胞,並在將胚胎移植到女性子宮之前對其進行染色體異常測試。在不孕症護理中使用的定義修訂後,以前的植入前遺傳學診斷(PGD)和植入前遺傳學篩查(PGS)術語已被術語PGT取代,包括用於非整倍性的PGT(PGT-A)、PGT用於單基因/單基因缺陷(PGT-M)和用於染色體結構重排的PGT(PGT-SR)[9].PGT於90年代初首次臨床應用,最初用於有傳播X連鎖隱性疾病風險的夫婦的病例[10]。從那時起,診斷出的疾病數量急劇增加,使用PGT實現健康懷孕的不同患者群體也是如此。目前,PGT被認為是產前診斷的替代方法[11],而相關方法稱為植入前遺傳篩查(PGS)用於提高ART的成功率。PGD適用於以下類別的患者:(1)單基因疾病的攜帶者,顯性和隱性,常染色體或X連鎖。(2)結構染色體異常、相互和羅伯遜易位、倒置、缺失、插入等的攜帶者。在大多數情況下,這些可能導致染色體重排與生命不相容或導致反覆流產(3)高齡產婦,以避免染色體異常後代。(4)輔助生殖治療(ART)後反覆植入失敗的夫婦。(5)反覆不明原因流產的夫婦。PGT-A和PGT-M技術允許選擇和隨後移植不太可能有染色體異常或沒有已知單基因疾病的胚胎,從而增加成功懷孕的機會,降低流產的風險,並健康的嬰兒。
需要PGT-A或PGT-M的患者會經歷典型的IVF周期。取回患者的卵子後,在實驗室中與丈夫或供體的精子受精。實驗室等待受精發生,讓胚胎發育5-6天進入80-100細胞囊胚階段。滋養外胚層活檢(圖 18.5)已取代卵裂期活檢,成為 PGT-A 活檢和合併 PGT-M 的首選方法。活檢方法的這種轉變與全面基因檢測的實施有關。
在囊胚階段,胚胎學家用雷射(胚胎活檢)在外殼上創建一個精確的微觀孔後,從每個胚胎中取出三到四個細胞,然後對這些細胞進行染色體分析。一旦確認染色體正常的胚胎,患者在適當的卵巢抑制和使用激素刺激的子宮準備後接受冷凍胚胎移植。冷凍胚胎移植可以在初始取卵後 5-6 周發生,但這取決於幾個因素。在大多數情況下,它隨後最多只能轉移兩個囊胚,並且在大多數情況下,建議轉移一個染色體測試的正常囊胚,以避免增加高階倍增的風險。根據ESHRE PGT聯盟的最新數據報告,PGT-M的前五種適應症是:囊性纖維化、亨廷頓病和1型強直性肌營養不良,這些仍然是常見的適應症,而遺傳性乳腺癌綜合徵和神經纖維瘤病的檢測比遺傳性血紅蛋白病和脆性X染色體病的分析更頻繁[12].PGT-SR、PGT-A 和並發 PGT-M/SR 和 PGT-A 的診斷檢測效率較高(超過 94%),而 PGT-M 的效率稍差 (88%)。未來幾年能否通過新的綜合技術提高效率還有待觀察。
18.3.6 歐洲國家的試管嬰兒結果
根據歐洲人類生殖與胚胎學會(ESHRE)的歐洲試管嬰兒監測聯盟(EIM)報告的數據,每次抽吸和每次移植的臨床妊娠率(PR)分別為28.0%和34.8%。ICSI後,相應的比率分別為24%和33.5%(表18.1)[13]。冷凍胚胎置換(FER)周期的懷孕和分娩率高於新鮮IVF和ICSI周期。當考慮替換胚胎的階段時,數據顯示囊胚移植的PR更高:分別為41.7%和卵裂階段胚胎的29.4%,用於新鮮IVF和ICSI周期。關於治療方式,雖然ICSI仍然是近年來應用最多的,其使用趨於穩定,但冷凍胚胎置換是第二大最常用的技術,並且冷凍胚胎的移植比例相對於新鮮的IVF和ICSI周期逐漸增加。
-
PESA,MESA和TESA是通過針吸術進行的手術:在附睪中使用不同的技術進行取樣。
-
TESE和微型TESE是外科手術:收集通過睪丸皮膚進行。
-
母親年齡在 40 歲或以上,或卵巢反應不佳的其他危險因素(如雙側卵巢子宮內膜異位症切除術)
-
先前IVF周期中的卵巢反應差(定義為在常規刺激IVF方案中檢索三個或更少的卵母細胞)。
-
低竇卵泡計數 (AFC)(少於 5-7 個卵泡),或低抗苗勒管激素 (AMH) 低於 0.5-1.1 ng/mL(3.5-8 pmol/L)。
-
1.外源性促性腺激素刺激多卵泡發育。
-
2.與促性腺激素釋放激素 (GnRH) 激動劑或拮抗劑聯合治療,以抑制垂體功能並防止早排卵。
-
3.在取卵前36-38小時觸發最終卵母細胞成熟。
-
開始藥物刺激多個卵巢卵泡的生長,同時給予其他藥物來抑制自然月經周期並下調垂體。
-
開始卵巢刺激藥物後,每隔一段時間進行監測以評估卵泡的生長。當卵泡達到適當的大小(19-20毫米)時,施用藥物使卵子最終成熟(稱為排卵觸發)。下一步涉及卵子收集(通常使用經陰道超聲探頭來引導拾取),在某些男性不育的情況下,取精。
-
接下來是受精過程,通常通過體外受精(IVF)或卵胞漿內單精子注射(ICSI)完成。
-
然後將胚胎放入子宮。這裡重要的問題包括子宮內膜準備、胚胎移植的最佳時機、移植多少胚胎、使用什麼類型的導管、超聲引導的使用、臥床休息的需要等。
-
輸卵管-腹膜因素(獲得性或先天性輸卵管疾病)。
-
中度男性不育症,當藥物手術治療或以前的宮內人工授精失敗或被判斷為不合適時。
-
嚴重的男性因素不育。
-
III級或IV級子宮內膜異位症。
-
免疫因素。
-
特發性不孕症,如果先前的宮內人工授精治療沒有產生結果或被認為不適合該夫婦。
-
冷凍保存的精液,與解凍後的精液質量有關。
-
反覆流產。
-
遺傳疾病/植入前遺傳篩查或診斷(PGT-A 或 PGT-M)。
-
游泳:精子可以根據其游泳能力進行選擇,稱為「游泳技術」(圖18.1b)。該技術通過在液化精液上分層培養基來進行。然後,活動精子游入培養物中。然後小心地除去上清液的上部以備進一步使用。
-
密度梯度選擇精子的第二種方法是使用密度梯度(圖18.1c)。將精液樣品移液到密度柱頂部,然後離心。密度梯度離心根據精子的密度分離精子。通過這種方式,您可以選擇具有最高梯度濃度的溶液中的運動性,形態上的精子,將其吸出以供進一步使用[4]。
-
第三種方法是結合離心的常規洗滌方法(圖18.1d)。將精液樣品用培養基稀釋並離心。隨後,將沉澱重懸於一點培養基中並孵育至授精時。
-
供體精子治療。
-
不明原因的不孕症。
-
子宮內膜異位症I-II期相關不孕症。
-
輕度男性因素不育(低生育力)。
-
宮頸因素不孕。
-
排卵因素不孕。
-
1.
將精子與含有脫膜因子、細菌、白細胞和細胞碎片的精漿分開。
-
2.
在小體積中以良好的漸進運動性濃縮儘可能多的精子。
-
腹腔鏡取卵,腹腔鏡下雄性和雌性配子(GIFT),受精卵(ZIFT)和/或胚胎(TET)的輸卵管內移植;
-
睪丸配子的顯微外科取樣:睪丸精子提取(TESE),顯微外科睪丸精子提取(microTESE),睪丸精子抽吸(TESA);
-
附睪配子的顯微外科取樣:經皮附睪精子抽吸術(PESA)和顯微外科附睪精子抽吸術(MESA)。
-
一級技術:更簡單和侵入性較小的技術,例如宮內人工授精(IUI)有或沒有卵巢刺激。
-
二級技術 可以在局部麻醉或深度鎮靜下進行的更複雜和更具侵入性的技術,這與基本技術不同,因為它們涉及對雌性和雄性配子的操作,並且因為它們需要體外受精。在這些技術中,IVF(體外受精和胚胎移植),ICSI(卵胞漿內單精子注射)以及雄性和雌性配子和胚胎的可能冷凍保存。
-
需要全身麻醉插管的三級技術程序,包括:
比較精子製備程序的說明 (a) 天然精子;(b) 游泳;(c) 密度梯度離心,和 (d) 洗滌離心
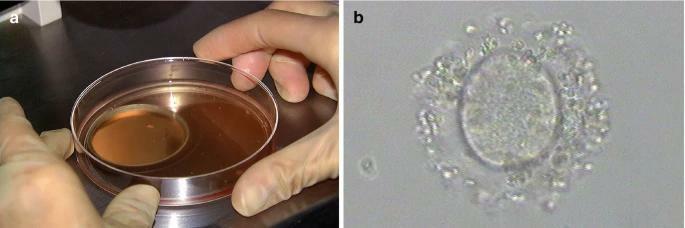

ICSI程序:將單個精子直接注射到卵子中以實現受精
圖 18.4
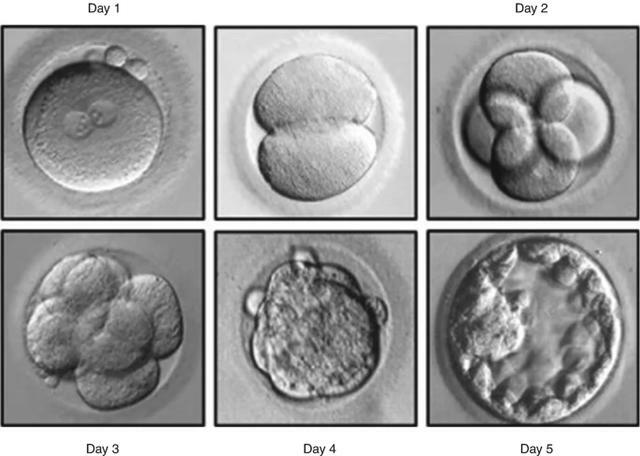
從受精卵(第1天)到囊胚(第5天)的胚胎發育階段圖 18.5囊胚滋養外胚層活檢
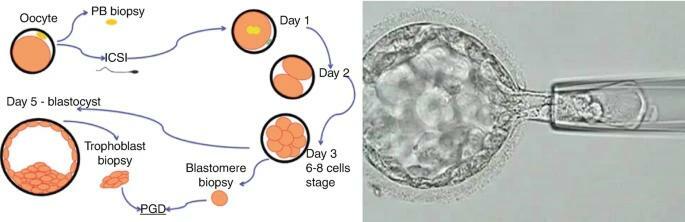
囊胚滋養外胚層活檢
18,4 藝術複雜功能
抗逆轉錄病毒治療可以減輕個人和家庭的不孕負擔,但它也可能給公共衛生帶來挑戰,抗逆轉錄病毒治療的多胞胎、早產和低出生體重分娩率高就證明了這一點。監測影響抗逆轉錄病毒治療的技術的結果已成為一項重要的公共衛生活動。母親和嬰兒的潛在健康風險描述如下。
18.4.1 卵巢過度刺激綜合徵
卵巢過度刺激綜合徵(OHSS)是輔助生殖技術的一種醫源性併發症。該綜合徵的特徵是卵巢囊性增大,由於毛細血管通透性和卵巢新生血管生成增加,液體從血管內轉移到第三間隙。其發生取決於人絨毛膜促性腺激素(hCG)的給藥。要了解OHSS及其管理,首先必須了解其嚴重程度的分類[14]。
職業健康安全防護等級描述如下:
18.4.1.1 預防職業健康安全:有效的干預措施
多巴胺激動劑可有效預防OHSS高風險女性的中度或重度OHSS。然而,多巴胺激動劑可能會增加不良事件的風險,如胃腸道症狀[15]。此外,與長GnRHa方案相比,使用促性腺激素釋放激素拮抗劑(GnRHa)可大幅降低OHSS,且無證據表明活產率存在差異[16]。OHSS率在GnRHa觸發時降低。然而,與hCG相比,接受GnRHa的女性活產率較低、持續妊娠率降低和流產率較高[17]。
18.4.2 多胎妊娠和早產
由於在大多數ART程序中會移植多個胚胎,因此ART通常會導致多胎妊娠和多胞胎。在歐洲,根據歐洲試管嬰兒監測聯盟(EIM)的最新報告[13]的數據,由於每次移植替換的胚胎數量減少,雙胞胎和三胞胎分娩的比例繼續下降。2017年,新鮮IVF和ICSI周期的雙胞胎和三胞胎率分別為14.2%和0.3%。冷凍胚胎置換的相應結果分別為11.2%和0.2%。多胞胎妊娠對母親的風險包括較高的剖宮產率、孕產婦出血率、妊娠相關性高血壓和妊娠糖尿病。嬰兒的風險包括早產、低出生體重、死亡以及出生缺陷和發育障礙的風險增加。此外,與未接受ART受孕的單胎嬰兒相比,接受ART受孕的單胎嬰兒發生低出生體重和早產兒的風險可能更高[18]。根據CDC ART監測報告的數據[19],在美國,儘管ART受孕早產兒和低出生體重兒的發生率一直在穩步下降,但ART受孕嬰兒中出生時低出生體重和早產兒的比例高於所有嬰兒。接受抗逆轉錄病毒治療的嬰兒的早產百分比(29.9%)高於出生總人口中所有出生的嬰兒(9.9%)。ART受孕嬰兒占所有早產兒(胎齡<5周)的3.37%。
18.4.3 抗逆轉錄病毒治療對女性的長期影響
荷爾蒙和生殖因素與乳腺癌和女性生殖道癌的病因有關。許多研究未能得出可靠的結論。荷蘭一項大規模隊列研究顯示,隨訪5年±8年後,未發現接受IVF的女性與未接受IVF的低生育力女性相比,乳腺癌和卵巢癌的風險沒有增加[20]。對於子宮內膜癌,在暴露於IVF和未暴露組中觀察到風險增加,表明與生育力相關的低生育效應需要進一步評估。
18.4.4 抗逆轉錄病毒治療對後代的長期影響
人們對抗逆轉錄病毒治療後出生的兒童的健康表示了極大的關注。特別是,男性因素生育能力低下的夫婦所生男孩的風險引起了人們的注意,因為在相當多的男性因素生育能力低下的案例中,可以懷疑遺傳原因。這些包括Y染色體微缺失,X染色體和常染色體畸變(即羅伯遜易位),以不孕症為特徵的綜合徵(即卡爾曼綜合徵)和具有遺傳基礎的超微結構精子缺陷(Meschede等人,2000)。從理論上講,通過ICSI,這些缺陷可能會遺傳給下一代男性。此外,根據最近的聲明,[21]ART的使用與單胎兒童的主要非染色體出生缺陷,心血管缺陷和任何缺陷以及雙胞胎染色體缺陷的風險增加有關。ICSI的使用進一步增加了這種風險,男性因素不育最多。這些發現支持僅在有醫學指征時才正確使用 ICSI。ART治療參數與低生育力夫婦生物學對這種風險增加的相對貢獻尚不清楚,值得進一步研究[21]。
4級—中度OHSS的特徵加上腹水和/或胸水以及呼吸困難的臨床證據。
5 級 - 以上所有情況加上血容量變化、血液濃縮導致的血液粘度增加、凝血異常以及腎灌注和功能下降。
3級—輕度OHSS的特徵加上腹水的超聲證據。
1 級 - 腹脹和不適
2 級—1 級疾病加噁心、嘔吐和/或腹瀉加卵巢增大 5 至 12 cm。
輕度職業健康安全
中度職業健康安全
重度職業健康安全
18,5 歐洲國家的藝術立法和法規
11個歐洲國家報告了關於抗逆轉錄病毒治療的具體立法;在法律上,無障礙僅限於 30 個國家的異性戀夫婦:阿爾巴尼亞、波士尼亞與赫塞哥維納、捷克共和國、法國、義大利、立陶宛、波蘭、斯洛伐克、斯洛維尼亞、瑞士和土耳其。共有18個國家為單身婦女提供治療,41個國家為女性夫婦提供治療。在五個國家,允許ART和IUI治療所有患者群體,包括不孕夫婦,單身女性和同性伴侶,男性和女性。38個國家允許使用捐贈的精子,32個國家允許捐卵,29個國家允許同時捐獻精子和卵子,14個國家允許胚胎捐獻。18個國家(奧地利,亞美尼亞,白俄羅斯,波士尼亞與赫塞哥維納,保加利亞,丹麥,冰島,義大利,哈薩克斯坦,挪威,斯洛維尼亞,瑞典,瑞士和土耳其)不允許胚胎捐贈。各主要國家的資料見表2.11。兩個國家不允許對單基因疾病或結構重排進行植入前基因檢測 (PGT),16 個國家不允許對非整倍體進行 PGT;代孕在18個國家被接受。除婚姻/性情況外,女性年齡是合法獲得抗逆轉錄病毒治療最常報告的限制標準,最低年齡通常定為45歲,最高年齡為51至35歲,有些國家不使用數字定義。在極少數國家設定了男性最高年齡。在允許的情況下,年齡通常是第三方捐贈者的限制標準(男性最大年齡55-34歲;女性最大年齡38-10歲)。第三方捐贈的其他法律限制是同一捐贈者所生的孩子數量(在一些國家,有來自同一捐贈者孩子的家庭數量),以及在6個國家,卵子捐贈的最大數量。表18.2報告了<>個主要歐洲國家的立法。
Cite this chapter
Matteo, M. (2023). Assisted Reproductive Technology. In: Bettocchi, C., Busetto, G.M., Carrieri, G., Cormio, L. (eds) Practical Clinical Andrology. Springer, Cham. https://doi.org/10.1007/978-3-031-11701-5_18