鹼性添加劑和鳥苷/葡萄糖酸鹽在濃縮紅細胞儲存溶液中的代謝作用
前言:
濃縮紅細胞是指從新鮮全血中去除了一部分液體成分,使紅細胞的濃度增加,得到一種高紅細胞濃度的製品,研究發現新型添加劑如AS-7(商業名稱SOLX)10或赤溶膠-5 (ESOL5)11設計基於氯化物移位的概念。
通過促進低氯化物/無氯化物/高碳酸氫鹽添加劑中的氯化物外排來促進細胞內pH鹼化 - 對能量和氧化還原代謝有益,通過用含有膜不滲透性陰離子(如葡萄糖酸鈉)的鹽代替鹽水成分可以獲得類似的效果,這會產生可逆的細胞內鹼中毒。
血液採集、處理和儲存
血液採集、處理和儲存詳見別處。簡而言之,從健康的志願者獻血者(n = 500)中收集了15mL的CPD抗凝劑血液。對於每個系列,由5個ABO兼容的混合血液單位組成的三個系列的重複被拆分,血漿和血沉棕黃層脫落。
隨後加入 110 mL 的各種添加劑溶液 SAGM、E-SOL5、PAGGSM、SOL-X (AS-7) 或 PAGGGM(均在內部製備),然後減少白細胞 (<1x106剩餘的白細胞)。
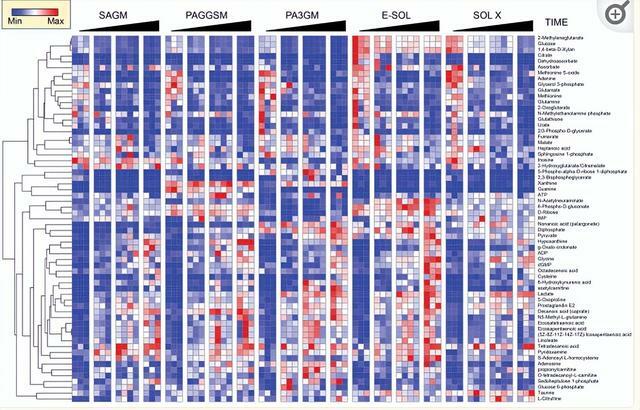
在儲存第1、21、35天和56天對單位進行無菌取樣。該採樣時間表背後的基本原理來自以下觀察結果:「在E-Sol 2和AS-3中儲存期間抑制了5,7 DPG的下降,而在PAG3M中,2,3-DPG水平在初始水平以上增加到第35天,並且直到第56天仍可檢測到。
在這裡,我們想測試這些對2,3-DPG的觀察是否也可以擴展到其他代謝途徑。在每個時間點以2,000g離心10分鐘,在4°C下分離紅細胞和上清液,並將紅細胞沉澱冷凍運送到代謝組學設施進行處理,如下所述進行代謝組學分析。
代謝物提取
在50μl裂解緩衝液(甲醇:乙腈:水450:5:3)中提取2μl包裝紅細胞的體積,然後在30ºC下渦旋4分鐘進行冰冷提取。38,47 通過離心(在10ºC和4,10×g下000分鐘)沉澱不溶性蛋白質,收集上清液並儲存在-80°C直至分析。
UHPLC-MS代謝組學
使用Vanquish UHPLC系統在線耦合到Q Exactive質譜儀進行分析。樣品在Kinetex C18色譜柱)在25ºC下,使用5%乙腈,95%水和0.1%甲酸的三分鐘等度條件,以250μl/min的速度流動,48或從9-400%B(A:水/ 5.95%甲酸;B:乙腈/0.1%甲酸)。
統計分析
使用GraphPad Prism 5.0(GraphPad Software,Inc,La Jolla,CA)和Metaboanalyst 3.0進行了圖形和統計分析,包括偏最小二乘判別分析(PLS-DA)和雙因子(時間序列+單因子統計分析)。49通過GraphPad Prism對所有測試存儲天數(三階多項式)的可用數據點進行插值,從而執行線圖。
最近已經描述了代謝連鎖分析。50簡而言之,使用GraphPad Prism 30.5和Microsoft Excel 0進行了相關分析(Pearson或Spearman相關性 – r - 使用Kolmogorov-Smirnov測試數據的正態分布)和Δ|r|>2017%偏差的計算,而結果則使用GENE-E繪製。
簡而言之,代謝連鎖分析的基本假設50即使相關性並不一定意味著因果關係,來自連接途徑的代謝物水平也是高度相關的,這是由於消耗一種代謝物以產生另一種代謝物所必需的酶促反應的生化限制。
氣體和離子穩態、滲透脆弱性、PS暴露和形態
測量不同添加劑中儲存的紅細胞的血細胞比容、平均細胞體積 (MCV)、pH 值、溶血百分比、滲透壓脆性、磷脂醯絲氨酸 (PS) 暴露和形態改變(報告為棘皮細胞的百分比)(部分先前報導過)46並在補充圖1和圖2中重新闡述)。
儘管由於缺乏紅細胞儲存質量和輸血功效的功能體內測量(例如輸血後恢復)的限制,但我們在這裡測量的參數代表了「功能」相關性的重要替代指標(例如自發性和滲透性溶血的百分比)。在整個儲存過程中,SAGM紅細胞的平均細胞體積(MCV)最高。
SAGM RBC 的儲存滲透壓脆性最高,在儲存期間呈增加趨勢(與之前的觀察結果一致)51),而其他添加劑則呈下降趨勢(補充圖1)。各種添加劑中的鹼化是通過高碳酸氫鹽負荷(SOLX)、低氯化物(PAGGSM)或無氯化物(PA3GM、SOLX和ESOL-5 – 補充圖2)實現的。
與SOLX和ESOL-3相比,PAG5M和PAGGSM的儲存pH值較低,儘管所有添加劑的趨勢大多相當。ESOL-5和PAG3M顯示出最低的儲存溶血端和最高的PS暴露,儘管所有添加劑在整個儲存過程中的形態分析中顯示出相似的棘皮細胞百分比。
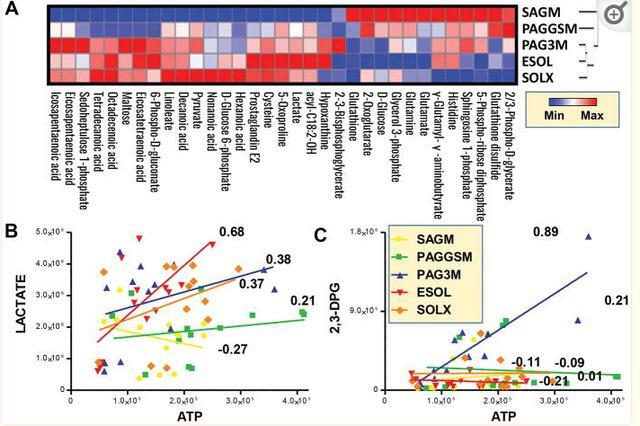
代謝組學 – 概述
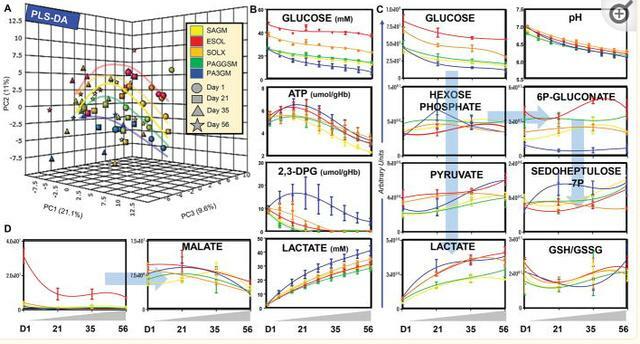
結果在補充表1中廣泛報告。對所有添加劑的代謝趨勢進行分層聚類,<並在圖1.在這些代謝表型的基礎上,我們通過偏最小二乘判別分析,表明PAG4M是唯一沒有顯示我們和其他人之前描述的PC3和1的典型U形級數的添加劑。
通過經典分光光度法和 UHPLC-MS PAG3M中一致地顯示出更高的葡萄糖消耗和ATP,DPG和乳酸的產生,其含有的葡萄糖初始劑量為SOLX和ESOL5的一半。特別是,儘管細胞內pH值較低,但PAG3M在整個儲存過程中更好地保留了DPG水平,其次是SOLX和ESOL-5。
儘管PAG3M顯示出最高的磷酸景天庚酮/6-磷酸葡萄糖酸鹽的比例,而ESOL-5最低(圖 2.C).在沒有通量數據的情況下,這一觀察結果表明,在PAG3M儲存的紅細胞中,通過磷酸戊糖途徑(PPP)的通量增加,表明NADPH產生(即氧化硫醇還原)的能力更高。
ESOL-5和SOLX的細胞內蘋果酸水平最高(所有添加劑的儲存量下降,可能是由於在上清液中釋放),儘管前一種添加劑中的檸檬酸鹽含量較高。
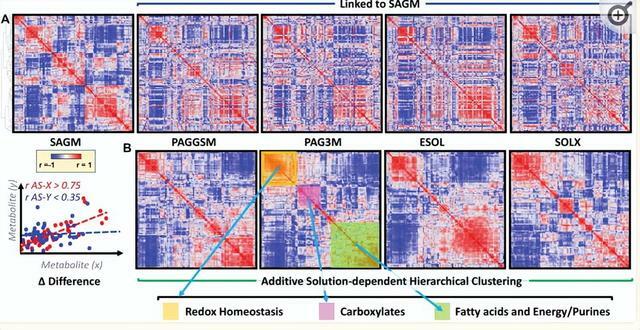
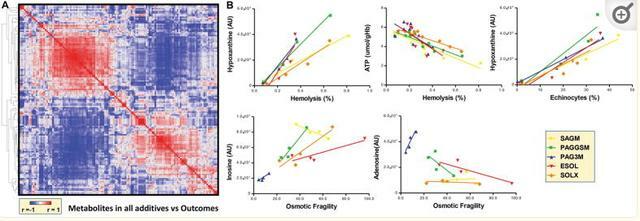
代謝連鎖分析允許測定儲存在不同添加劑中的紅細胞的代謝重編程。這種方法的基本原理是酶促反應的生化約束導致相同途徑中代謝物之間具有強烈且顯著的正/負相關性,除非級聯中一種酶的活性被調節事件上調/下調。
SAGM RBC 中的代謝物水平相互關聯,然後對所有添加劑重複類似的相關性分析,同時保持 SAGM 中原始闡述的代謝物順序或以逐加的方式執行相關性的分層聚類 (圖 3.B).該分析一目了然地概述了添加劑之間的代謝重新布線,表明與SAGM相比,對鹼性添加劑中的氧化還原穩態,羧酸,脂肪酸和嘌呤代謝有很強的影響。
值得注意的是,在總穀胱甘肽水平方面,在添加劑中觀察到穀氨醯胺代謝和穀胱甘肽穩態的變化。SAGM在儲存的前21天顯示出最高的GSSG水平。與其他添加劑相比,半胱氨酸在儲存期間在ESOL-5紅細胞中顯著積累,主要是在儲存第56天的單位過期時。
嘌呤和脂肪酸代謝
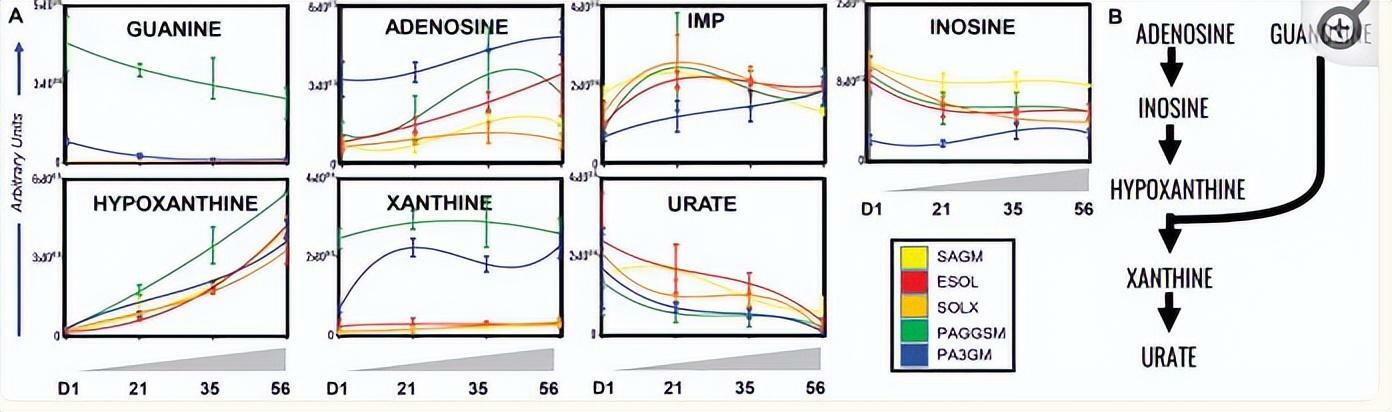
與本文測試的所有其他添加劑相比,在PAGGSM和PAG3M中補充鳥苷導致鳥嘌呤和腺苷水平顯著升高,肌苷(尤其是PAG3M)水平相對較低(圖4).這表明來自PAGGSM和PAG3M的鳥苷主要通過磷酸分解而不是次黃嘌呤鳥苷磷酸核糖轉移酶(HGPRT)代謝。
脫氨嘌呤在PAG3M中最低,另一方面,尿酸鹽與黃嘌呤的比率在ESOL-5和SAGM中最高,其次是SOLX(圖4).從穩態數據推斷,這些結果表明SAGM和ESOL-5中的嘌呤脫氨和分解代謝尿酸鹽增加,部分緩解了SOLX。
代謝組學數據與功能結局的相關性
代謝組學數據與功能結局(包括由ATP水平確定的能量狀態、溶血、滲透脆性、PS暴露和形態改變)相關和與添加劑無關的方式,所有添加劑中與ATP具有顯著正(紅色)或負(藍色)相關性的頂級代謝物概述見圖,A。
值得注意的是,觀察到的大多數趨勢都顯示出越來越高的趨勢(例如乳酸和ATP –圖 5.B)或所有添加劑的相關性較低(例如ATP和1-磷酸鞘氨醇)(圖 5.A).除PAG3M(圖 5.C),建議重新布線特定於該添加劑的Rapoport-Luebering分流器。
值得注意的是,嘌呤代謝物(尤其是ATP、腺苷和脫氨產物肌苷和莨菪嘌呤)與功能結局的相關性最好,次黃嘌呤是所有添加劑中溶血和形態改變(20%棘皮細胞)的最佳預測因子。值得注意的是,肌苷是除SAGM。
結論:
在本研究中,我們首次對儲存在不同鹼性添加劑SOLX,ESOL-5和PAG3M或非鹼性/經典添加劑中的紅細胞進行了比較代謝組學分析,我們的代謝分析結果表明,與其他鹼性添加劑相比,PAG3M中的紅細胞保存效果更好,並且通常,與非鹼性SAGM和PAGGSM相比,在鹼性添加劑中具有更好的紅細胞保存效果。
特別是,與SAGM和PAGGSM相比,PAG3M和其他鹼性添加劑的DPG和ATP的產生和維持,以及嘌呤代謝和氧化還原穩態(特別是PPP及其非氧化相副產物)是有利的,然而,觀察到的代謝益處並未擴展到預防儲存誘導的脂肪酸釋放和脂質氧化。
來自這些途徑的代謝物與功能結局的替代離體指數的相關性是相關的,因為它們證實並擴展了最近對嘌呤脫氨在輸血後紅細胞恢復中的作用的觀察,然而,額外的功能性體內測量將有助於進一步擴展我們對這些儲存添加劑對輸血功效影響的理解。
本研究的結果為鹼性儲存添加劑的代謝益處提供了額外的見解,並可能在不久的將來指導新型添加劑的配方。