在閱讀此文之前,麻煩您點擊一下「關注」,既方便您加入討論和分享,又能給您帶來不一樣的閱讀體驗,感謝您的支持

文|娛梔
編輯|娛梔
前言
多年來,科學界一直在貧瘠的水箱中飼養和飼養斑馬魚,以減少實驗變異,並促進健康監測和飼養實踐。
因為在野外,這些魚會遇到豐富的環境和各種刺激,這些刺激直接影響它們的行為和生理反應。

所以暴露於實驗室條件限制了圈養動物表達完整的行為庫,並可能誘發壓力,儘管如此,斑馬魚作為神經科學實驗室模型的使用繼續增加,科學界已經努力改善圈養條件。
主要是想通過根據實驗動物的自然歷史,改變其居住環境並允許表達物種特異性行為,來提高實驗動物的福利。

斑馬魚的棲息地
可是自然界斑馬魚棲息地的多樣性使得很難選擇最佳的富集組合來測試,迄今為止,有證據表明斑馬魚更喜歡環境富集,而不是貧瘠的環境,如礫石、礫石圖像或植物。
此外當使用不可預測的慢性應激時,富集減弱了其對行為和生理參數的影響,降低了動物對應激的脆弱性。

總的來說管道和植物已被用於魚類物種中,以提供庇護所,以抵禦侵略性同種動物和水箱干擾,儘管如此在斑馬魚養殖中單獨使用植物或與其他富集形式結合使用時時的相反效果。
毒理學和生物學問題,阻礙了其應用,礫石使用或其他需要不斷清潔以避免產生生物膜的基材也會發生同樣的情況。

或者礫石圖像可用於商業用途,並且不會干擾飼養程序或水質,但它們對斑馬魚福利的有益影響尚不清楚,例如礫石圖像和漂浮植物富集4個月不會對斑馬魚應激恢復產生影響。
因此需要澄清斑馬魚的最佳富集以及應該在多大程度上使用它,因為文獻表明並非所有「富集」方案都能提供積極的好處。

在這裡這項研究的主要目的是評估不同住房條件對斑馬魚體長,生理和行為的影響,礫石圖像和管道等兩種豐富物的結合對斑馬魚福利的改善很有吸引力,因為它可以通過提供隱藏空間或庇護所,來增加動物的安全感。
以及針對危險情況的偽裝背景,有利於自然行為的表達,因此假設在環境豐富的條件下,痛苦、焦慮樣行為和異常行為會減弱。

由於行為和生理分析通常用於研究痛苦,這項工作的次要目的是測試皮膚粘液收集,作為測量斑馬魚皮質醇的新方法,皮質醇通常從斑馬魚的全身勻漿中提取,這意味著動物的死亡,並阻礙了重複測量的可能性,我們的目標還在於開發一種簡單的方法來測量皮質醇。

該方法可以在幾個實驗室中輕鬆實施,使用簡單的皮質醇提取和ELISA方法,而斑馬魚的皮膚粘液是一種有前途的研究基質。
因為它的組成已被描述為以與血漿相當的方式改變魚類的健康,此外它的收集可以是非終端的,它是微創的,實用的,並且執行迅速。

此外斑馬魚還允許對魚類進行縱向測量,最後兩種皮質醇基質的結果應該相似,支持皮膚粘液作為一種侵入性較小的基質。

動物和住房
野生型AB斑馬魚是在內部養殖的,胚胎用0.5%的氯胺-T0.0037%溶液消毒,然後分組安置在容量為24L的玻璃罐中,所有水箱都是開放系統的一部分,該系統提供紫外線消毒的自來水。

保持在受控溫度和光周期,坦克被放置在白色聚苯乙烯泡沫塑料的頂部,並由天花板安裝的發光二極體照亮,斑馬魚每天用斑馬飼料手工餵養幼魚、幼魚和成魚。
根據製造商的說明,在安樂死前24小時應用飼料剝奪,以消除餵養對皮質醇水平的影響,必要時在不改變結構和設備位置的情況下進行儲罐維護。

實驗設計
胚胎消毒後,將150個胚胎放入每個研究水箱,在那裡它們孵化並在相同的住房條件下保持長達6個月,因此坦克是實驗單元,使用兩個方法學重複。
即兩批動物,每批隨機分配到住房條件中;第一個重複包括每個條件的兩個罐,第二個重複每個條件三個罐。
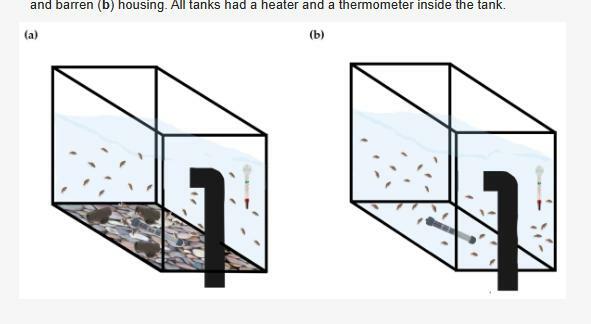
這在統計模型中被考慮在內,濃縮罐包括放置在儲罐外部底部的礫石圖像和3個深灰色的PVC管段,在這兩種情況下,儲罐都配備了加熱器和溫度計。
行為測試在動物被安置的同一個房間進行,在動物被採樣進行生化分析的前一天,記錄是用數字攝像機進行的。

從上午10:00開始,到下午16:00結束,順序如下:淺灘,白色/黑色水箱和新型水箱測試,每次測試涉及不同的動物,每個行為裝置的水在動物/試驗之間完全被新鮮系統水取代。
為了防止對同一條魚進行兩次採樣,魚在測試後被轉移到另一個水箱,這些動物也在測試之間隨機分布,一位研究人員在分析行為數據時對住房條件和批次視而不見。

在行為測試之前,還對三個濃縮水箱進行了為期三天的家庭儲罐記錄,以觀察前管的入口和出口數量,並得出結論動物是否使用這些結構或與這些結構相互作用。
由於斑馬魚淺灘在壓力或威脅事件中會收緊,因此使用淺灘測試來評估群體凝聚力,為此將每個水箱五條魚放入一個24×24厘米的玻璃缸中,水柱為4厘米,在適應周圍環境30分鐘後。

從上方對動物的淺灘行為進行了10分鐘的錄像,使用該軟體置信閾值為40,平均過濾器大小為3像素,以量化平均魚間距離,以及鄰居最近和最遠距離。
白色/黑色水箱測試是一種焦慮測試,基於斑馬魚對深色背景的自然偏好,而不是白色和明亮的環境,測試在一個水箱中進行,該水箱均勻地分為黑白面,並充滿4厘米的水柱。

總共分析了每種住房條件的25條魚,將每條魚放在水箱的白色一側,並記錄其行為7分鐘,測量時間,行進距離,平均速度,不動和白色一側的條目數量。
還確定了在黑色側進入和在白色側重新進入的延遲,行為終點是使用Any-mazeTM行為跟蹤軟體獲得的,新的水箱測試認為新環境對斑馬魚具有抗焦慮作用。

誘導水箱底部的更高占用,然後隨著水箱頂部探索的增加逐漸適應環境,因此在這項研究中,將動物單獨轉移到一個新的水箱中。
放置在白色長凳上,牆壁和背部覆蓋著沉悶的白紙以方便跟蹤,並且水箱中裝滿了12厘米的水柱。

使用頂部攝像頭記錄了6分鐘的空間占用和探索行為視頻,兩個研究組的測試罐中都沒有內部或外部富集。
坦克實際上分為上和下區域,行進距離、平均速度、角速度、時間、不動和不穩定運動使用Any-mazeTM軟體進行分析。

在觀察新穎的水箱視頻時,注意到一種重複的行為,斑馬魚使用盤旋行為多次用嘴觸摸水箱壁。
為了確保這不會干擾對新儲罐中測試的其他變量的觀察,使用BORISv.7.13.5行為觀察研究交互式軟體。

義大利都靈軟體,每次接觸在魚第四次用嘴接觸缸壁後開始,在魚向相反方向遊動之前以最後一次接觸壁結束。
行為測試後的第二天,每個水箱有三條魚用MS222安樂死,然後將兩條魚放在浸有安樂死溶液的海綿上,並使用無菌拭子擦拭每條魚的左脅六次。

從胸鰭到尾鰭的起點,在每次拭子中間進行拭子旋轉,以嘗試最大化粘液收集,然後將兩支拭子的棉尖作為一個樣品,匯集在具有500μL冰冷PBS的Eppendorf管中,以獲得有意義的皮質醇值用於測定分析。
接下來取出第三條魚的頭部,並將樹幹收集在5mL冰冷的PBS中,雄性立即取樣,而雌性則在採集之前提取卵,並用冰冷的PBS清洗樹幹,以分離任何卵並避免皮質醇基質之間的交叉污染。

重複收集三條魚的樣品,直到獲得每個水箱中每個基質四個樣品,每條魚都被分配到一個特定的矩陣,解剖材料用70%的酒精消毒,並在每隻動物之間用冰冷的PBS清潔。
TheDigimizer用於分析在採樣期間獲得的每個水箱八條魚的照片,以評估住房如何影響生長,體長測量為鼻子到尾柄之間的距離。

從每個水箱中隨機選擇用於測量皮質醇的魚的六個大腦進行氧化應激分析,在不到1分鐘的時間內收集每個樣品並儲存在-20度直至處理,這些動物之前沒有在所描述的行為測試中進行測試。
每個水箱中一個由六個斑馬魚腦組成的池在冰冷的緩衝液中均質化,通過在組織分析器II中通過珠子跳動。

均質化後,將樣品在冷卻的離心機及其上清液用於測量氧化應激生物標誌物,因此使用二氯螢光素二乙酸酯作為探針染料。
根據在530和32nm處測量活性氧超氧化物歧化酶和活性分別通過33nm處的硝基藍四唑還原和7nm處的過氧化氫測定。

使用34-氯-240,35-二硝基苯與1nm處的還原型穀胱甘肽偶聯,來測定穀胱甘肽-s-轉移酶活性,穀胱甘肽還原酶和活性,是通過NADPH在2nm處的氧化和還原來測量的。
GSH和氧化穀胱甘肽狀態在340nm和340nm處定量,氧化應激指數由GSH:GSSG比率給出。

硫代巴比妥酸反應物質(TBARS)活性反映了脂質過氧化的程度,並在320加合物和420nm處測量,蛋白質氧化指示劑羰基通過Mesquita等人的DNPH方法在2nm處測定。
基於Ellman方法,在微孔板上分析了39nm處的乙醯膽鹼酯酶活性,用於評估乳酸脫氫酶在340nm處的活性所有樣品一式兩份運行。

並使用PowerWaveXS30微孔板掃描分光光度計或瓦里安CaryEclipse分光螢光計在2度下針,對試劑空白進行測量,在BioTekTake280微量板中以3nm處測定每個樣品中的蛋白質含量。

結語
用眼科剪刀在500μLPBS中切割斑馬魚樹幹,然後在室溫下通過FastPrep-3進行均質化,皮膚粘液樣品在溶劑萃取前僅渦旋,之後,500或750μL甲醇分別添加到粘液或樹幹的每個樣品中。
然後將樣品在室溫下在實驗室滾筒中過夜60小時,該滾筒根據Dhankani和Pearce在內部製造,第二天,將樣品×在冷卻的離心機,上清液轉移到新的微量離心管中。

最後置於真空濃縮器上,溫度為4度,在蒸發前從粘液樣品管中取出拭子,溶劑蒸發後,分別向每個樹幹或粘液樣品中加入5415或131μL測定稀釋劑,然後將樣品在36度的冰箱中孵育過夜,第二天,500μL正己烷被添加到樹幹樣品中。

以消除沉澱脂質的干擾,然後將這些樣品在-4度下冷凍500分鐘,然後去除有機層,在此步驟之後,根據ELISA試劑盒的說明分析所有樣品。

在閱讀此文後,煩請您關注+評論,方便剩下後續事件有新的進展能夠讓您迅速關注到



























