2019 年,著名主持人趙忠祥罹患鱗狀細胞癌,就醫時發現癌症已經擴散,幾個月後不幸去世。鱗狀細胞癌又名表皮癌,多見於有鱗狀上皮(一種上皮組織)覆蓋的部位, 包括皮膚,肺,消化系統,生殖系統等等。
多數鱗狀細胞癌被及時發現之後,可以通過手術切除治癒。但是,當在癌症晚期出現癌細胞轉移時,一般與較差的預後相關。
鱗狀細胞癌的復發率接近 10%,復發之後的腫瘤具有一定的侵襲性,因此更加難以治療。儘管鱗狀細胞癌的轉移率只有 0.3-3.7%,它的高發生率意味巨大數量的晚期病患, 尤其在免疫缺陷的病人中常見,一旦發生轉移就會給患者帶來較大影響。
目前,要想對抗這類癌症還有一個未滿足的需求,即如何定義和區分良性腫瘤和惡性腫瘤的分子特徵,並利用這些差異特徵推進癌症預防和治療。
從良性乳頭狀瘤進展到晚期鱗狀細胞癌,通常被認為是轉移級聯的初始過程。轉移之前的腫瘤細胞會改變其分子和細胞狀態,從而侵入周圍的間質並進入體循環。這一現象常見於頭頸、肺和子宮頸等部位的鱗狀細胞癌。
為了防止轉移,了解鱗狀細胞癌的早期進展至關重要。有研究表明,化學誘變劑只會誘發少數的散發性良性腫瘤,偶爾會進展為鱗狀細胞癌。
此前,學界針對人類轉移性癌症進行了批量測序,發現了數百個基因突變,進一步支持了「多步誘變」假說。
最近有研究表明,腫瘤可以在僅有少數突變的情況下達到高度惡性的狀態。因此存在這樣一種可能性,即在腫瘤發生的早期階段,採用非遺傳手段有望推進癌症治療。
而在當前,在可以塑造腫瘤行為的影響因素中,人體組織微環境的重要性愈發受到關注。人們也發現,微環境可以影響惡性腫瘤的狀態。

治癌新手段:以更大的力度干擾腫瘤幹細胞
洛克菲勒大學大衛·洛克菲勒生物科學系博士元紹朋(Shaopeng Yuan)所在團隊的前期研究已經證明:位於腫瘤-間質界面的鱗狀細胞癌,產生於細胞群里的腫瘤幹細胞,它們不僅可以增強腫瘤的啟動能力,而且能夠抵抗化療和免疫治療。

但是,科學家們依然不太清楚的是:在人體健康組織的微環境中,腫瘤幹細胞是否可以調控惡性進程?如果可以,其機制是什麼?
為解決這一問題,元紹朋和同事利用實驗室此前建立的基因工程小鼠皮膚癌模型,在小鼠子宮內的個體皮膚幹細胞里,轉導誘導型反式激活因子和 TGBb-報告基因,然後通過激活 HRASG12V 驅動腫瘤發生,從而生成克隆性腫瘤。
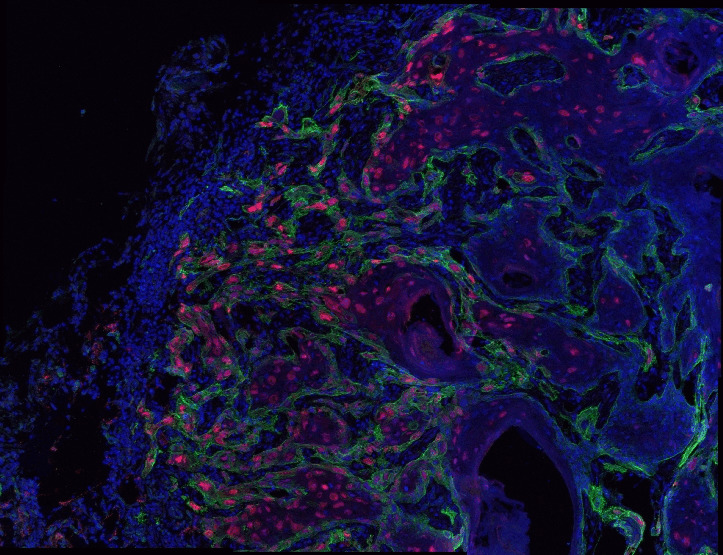
結果發現,這些小鼠的皮膚腫瘤極具異質性,即兼具良性和惡性的浸潤區域。這說明在這些混合腫瘤中,包含大量的侵襲性細胞,可以增加對於化療和免疫治療的抵抗力。
接著,課題組改變研究策略,在 HRASG12V 激活後立即監測腫瘤發生,並在皮膚幹細胞從良性轉為惡性時對這一過程進行追蹤。
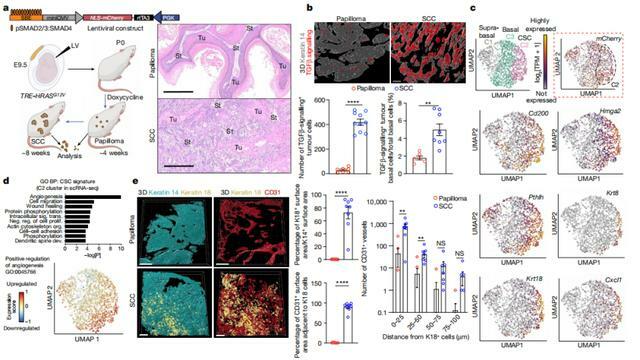
該團隊對於侵入性鱗狀細胞癌的基底層腫瘤幹細胞進行了單細胞 RNA 測序,隨後在接收 TGBb 信號的腫瘤基底幹細胞中,他們發現了此前未被重視的異質性。
對於這一特徵,課題組展開了追溯,並揭示了它出現在 HRASG12V 被激活之後的原因。他們發現如果組織幹細胞在腫瘤驅動基因中發生突變,組織幹細胞就能啟動一條前饋信號通路,從而觸發惡性腫瘤的自我傳播途徑。
接著,他們將這一改進後的腫瘤幹細胞特徵,與其他腫瘤幹細胞特徵加以區分。結果發現在腫瘤發生惡性轉變時,腫瘤微環境中脈管系統和 TGBb 信號通路出現了峰值。
有趣的是,此時被激活的 43 個鱗狀細胞癌幹細胞基因中,出現了膜受體 LEPR,它的配體瘦素由脂肪細胞產生,在正常情況下可以通過脈管系統攜帶到靶組織。
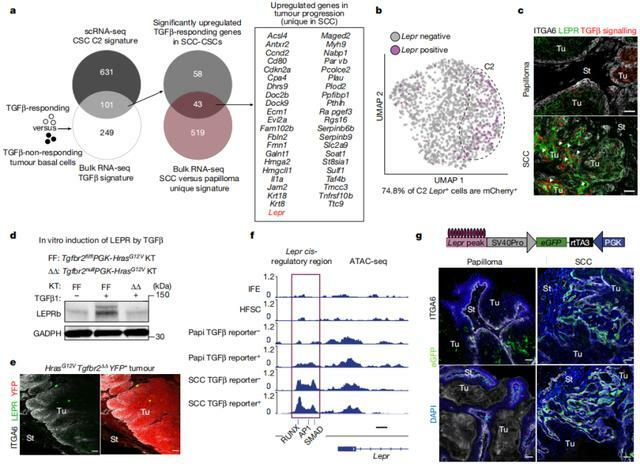
研究中,該團隊表明 LEPR 是 TGBb 信號傳導的直接靶標,它讓致癌基因 RAS 得以重塑腫瘤微環境,從而創造一場「完美風暴」,讓新興腫瘤幹細胞內的 LEPR 配體信號得到傳導。
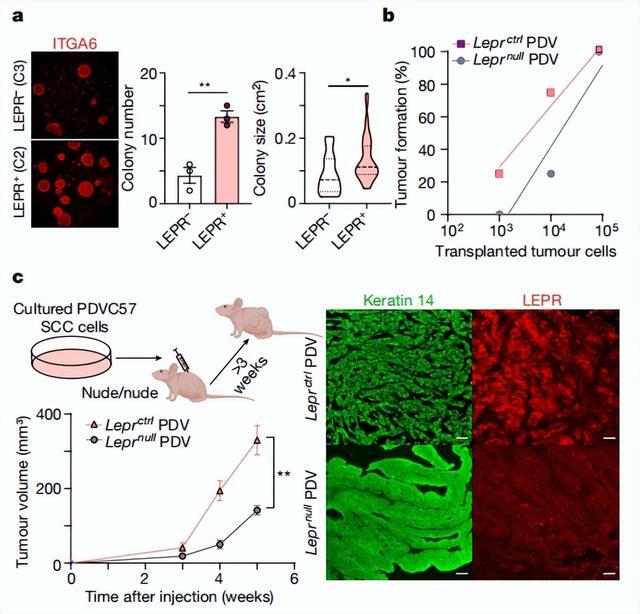
反過來,這也會催化幹細胞中 PI3K-AKT-mTOR 信號的傳導。這說明腫瘤微環境驅動的級聯信號通路,對於驅動惡性腫瘤至關重要。
另據悉,LEPR 在乳腺等脂肪組織的癌症中過度表達,它與瘦素過度表達的肥胖小鼠模型中腫瘤發病率的增加有關。
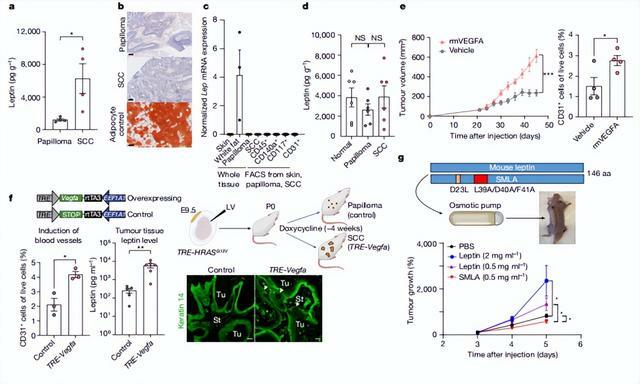
截止目前,LEPR 在非肥胖、非脂肪組織環境中的作用尚未得到徹底的探索。但是,通過非瘦素上調的方式,肥胖會增加腫瘤的易感性,因此探索 LEPR 具有重要意義。
元紹朋表示:「這項研究的『美妙之處』在於,我們專注於研究單個致癌基因對於腫瘤微環境的影響,而不是研究如何通過其他方式引入腫瘤微環境的變化。」
概括來說,此次成果帶來了三個新概念:
其一,他們展示了致癌驅動因素 RAS 觸發前饋信號通路的原理。
其二,他們發現了此前未被重視的「完美風暴」,該「風暴」由幹細胞驅動。
藉助觸發血管生成的峰值,腫瘤微環境會得到進一步的重塑。反過來又會改變幹細胞的行為,從而在腫瘤幹細胞上表達新的膜受體,進而利用腫瘤微環境推動下游的癌症通路。
其三,他們為一種可以自我傳播的新型非遺傳信號級聯提供了功能證據,並表明其對於驅動惡性侵襲性癌症具有重要作用。
近日,相關論文以《Ras 通過幹細胞與微環境的串擾驅動惡性腫瘤》(Ras drives malignancy through stem cell crosstalk with the microenvironment)為題發在 Nature 上,元紹朋是第一作者,美國洛克菲勒大學哺乳動物細胞生物學和發育實驗室教授伊萊恩·福克斯(Elaine Fuchs)擔任通訊作者。

元紹朋表示,當腫瘤幹細胞與微環境處於「不正常的交流」時,TGBb 介導的瘦素受體信號激活、以及 PI3K-AKT-mTOR 軸的激活,都會導致良性腫瘤轉惡。
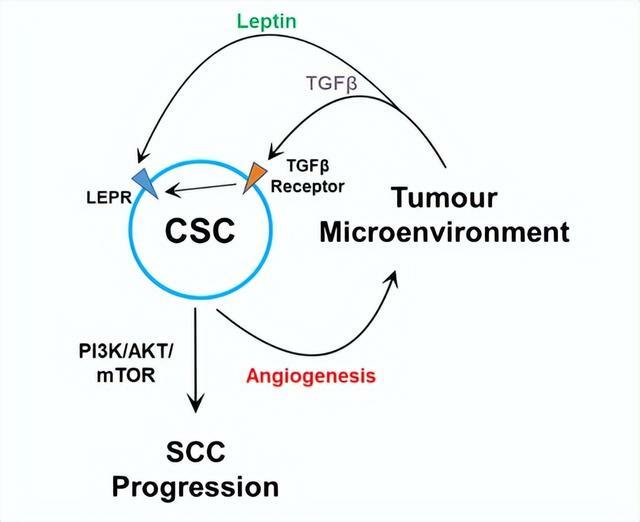
而腫瘤幹細胞是導致化學療法和免疫療法失敗的主要原因之一,因此如能同時阻斷這些不正常的腫瘤幹細胞信號,則能對化學療法和免疫療法中逃逸的幹細胞,起到強大的壓製作用。因此,在現有療法上增加腫瘤幹細胞的干擾療法,將是一個頗具前景的應用方向。

刷新人們對於腫瘤變化的理解
元紹朋說:「此次課題並不是我和導師最初定下的目標。一開始,我們的目標是上皮-間充質轉化。這是一個複雜的發育程序,癌細胞可以抑制它的上皮特徵,從而讓其轉為間充質特徵。」
這種變化帶來的作用是,能讓細胞獲得移動性,並能讓細胞具備從主站點遷移的能力。
但是,他們發現在鱗狀細胞癌良轉惡的過程中,只發生了一部分的上皮-間充質轉化,也就是並沒有完全失去上皮特徵。基於此,他們打算把研究目標調整為:分析良轉惡腫瘤的分子和細胞特徵。
通過病理學分析,他們發現在惡性腫瘤樣品中,有很多良性病變混雜其中。而在早期惡性腫瘤里,則會出現良性和惡性腫瘤細胞混合的信號。
此前,多數關於鱗狀細胞癌的文獻都顯示,很多腫瘤還停留在良性腫瘤階段、或者早期混合型的惡性腫瘤階段。
因此,該團隊決定從病理學角度進行定性分類,即針對完全良性的腫瘤、以及完全侵入性的惡性腫瘤進行深度分析,藉此發現了一些重要分子和細胞生物學特徵。
而當發現 LEPR 這一重要指標時,他們才意識到之前發現的血管生成、以及從免疫細胞而來 TGBb 的信號,都是「大棋局」中的一部分。
「研究進行到這裡,我們並未停下腳步,也希望了解上游信號的成因,所以我們對於正常幹細胞中、處於不同階段的腫瘤幹細胞,進行了表觀遺傳學分析。結果發現對於病理進程來說,它會和重要的轉錄因子一起出現在開放型染色質區域裡。」元紹朋說。
尤其值得注意的是,在正常的皮膚幹細胞里,LEPR 是一個完全不表達的基因。然而,隨著鱗狀細胞癌的進展,與 LEPR 相關的一個染色質區域也在慢慢開放。
研究中,課題組使用病毒載體,標記了腫瘤的侵入前線細胞。通過此他們發現,上游內部信號 Ras 所導致的轉錄因子可以打開染色質,而外部信號 TGBb 則能讓 Smad 蛋白進入開放染色質。
元紹朋說:「以前我們一般認為,外部細胞和癌症細胞只會在微環境進行交流和單循環。但是本次研究證明:當內外信號和幹細胞在癌症微環境裡交流時,也能產生腫瘤良轉惡的現象。而在此前認知中,人們一般認為只有出現大量基因變異時才會導致這種現象。」因此,該研究刷新了人們對於腫瘤進展的理解。
接下來,需要進一步了解瘦素受體如何在細胞信號學上達成上述作用。此前,神經科學和代謝科學的學者們已經發現,該受體的下游信號,尤其是 STAT3 信號,可以催生大量的通路激活。
但是,該團隊發現 STAT3 在良性腫瘤階段就已經激被活,而且不一定和 LEPR 有關。
為此,他們進行了大量的測序分析和通路分析,結果發現在小鼠模型中,瘦素受體藉助 PI3K-AKT 通路作用,讓病理進程發生了變化。
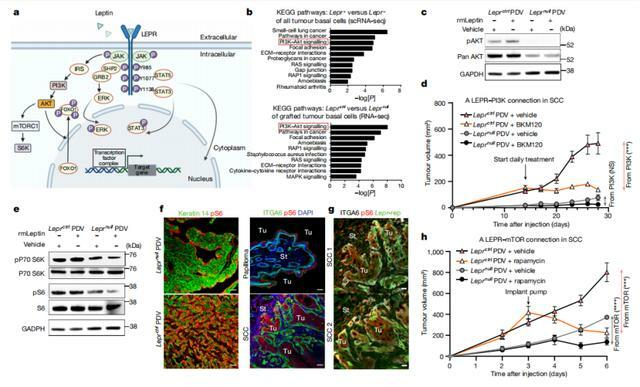
最後,課題組加了抑制劑的小鼠實驗,證明瘦素受體通過 TGBb-LEPR-PI3K-AKT-mTOR 通路,實現了腫瘤的良轉惡。

師從四院院士,7 年「長征」幸獲導師無條件支持
元紹朋表示:「研究中,我們使用 Smartseq2 進行了單細胞 RNA 測序。論文第二作者 Katie Steward 博士和我討論之後,我們決定放棄使用 10X scRNAseq,主要原因是瘦素受體的表達並不是很高。為了防止漏掉信號,我們選擇使用 SmartSeq2 技術。」
這也意味著,至少需要 1200 個細胞才能起作用。最初元紹朋並沒有在意,到了做實驗時才發覺大部分此類實驗只有 100-300 個細胞,而且還得手動操作實驗。
為此,他們只好準備 24 個 96 孔 PCR 盤,每天操作實驗兩個小時,直到三個月後才得到了scRNAseq 資料庫。
「很多同事都對我們如此苦力般的實驗露出了苦笑。S. Martina Parigi 博士是一個非常謹慎的人,經常對實驗結果『憂心忡忡』。她提議要對 PI3K 抑制劑腫瘤小鼠實驗進行雙盲設計。那陣子,她每天都通過食管給小鼠注入藥劑和安慰劑,而做腫瘤測量的我則在動物實驗室慢慢等待。」元紹朋說。
在如此嚴謹的實驗之下,他們證明了所提假設中的通路不僅重要,而且具備用於轉換醫學的潛力。
元紹朋繼續說道:「另一位論文作者 Merve Deniz Abdusselamoglu 博士負責了大量的免疫螢光實驗。但是,在編撰論文時她卻曾推辭共同作者,這種謙遜的態度非常少見。還有一位論文作者 Yihao Yang 是我的好友和合作夥伴,他不僅提供了專業的表面基因學分析,也對論文嚴謹性提供了支持。他經常一邊笑我作為生物學者卻不會用 Illustrator,一邊把替我把圖文處理得很漂亮。在此也向他們表示感謝。」

另外,這項工作歷時 7 年,不僅耗費了大量資源,而且很多開創性實驗的風險也很高。但是,元紹朋的導師伊萊恩·福克斯教授頗有前瞻眼光,即便一時看不到前景,也給予了無條件的支持。
伊萊恩是洛克菲勒大學哺乳動物細胞生物學與發育實驗室負責人,以基於哺乳動物皮膚和皮膚疾病的細胞生物學和幹細胞分子機制研究而知名。她是美國文理科學院、美國國家科學院、美國國家醫學院、以及羅馬宗座科學院的「四院院士」,同時也是英國皇家學會的外籍會士。

另據悉,元紹朋博士畢業於加州大學伯克利分校生物工程系和洛克菲勒大學大衛·洛克菲勒生物科學系研究生項目,目前他是美國癌症研究協會和美國科學促進會的會員。接下來,如何阻斷癌症幹細胞和微環境的交流,將是他下一步的研究重點。
參考資料:
1.Yuan, S. et al. Ras drives malignancy through stem cell crosstalk with the microenvironment. Nature 612, 555–563 (2022).
https://doi.org/10.1038/s41586-022-05475-6
2.Senft, D. Leptin fuels non-genetic skin tumour progression. Nat Rev Cancer 23, 56 (2023).
https://doi.org/10.1038/s41568-023-00548-8
3.RAS Drives Malignancy through Altered Stem Cell/Microenvironment 2022 Dec 16, OF1.
https://doi.org/10.1158/2159-8290.CD-RW2022-217