胰腺癌是一直關注並追蹤最新藥物研發進展及臨床進度的難治性癌種,在既往的公眾號文章中也就免疫聯合化療和/或放療的多種治療聯合方案進行過整理。胰腺癌,本身具有免疫抑制微環境,且為強結締組織。導致相關藥物研究進展一直處於緩慢狀態。而化療治療手段,能夠有效減少相關缺陷,成為治療的首選方案。而隨著免疫治療在其他實體瘤領域的研究進展,在胰腺癌領域也有突破曙光,主要研究方向之一為相關免疫微環境的研究探索。本文就cell期刊上的一篇文獻及2023 ASCO GI大會上的一篇摘要進行整理。
——胰腺癌流行病學——
胰腺癌亞洲發病率遠高於全球的發病率,有機構預測,從2018年到2040年,胰腺癌的新發和死亡增長比例將達到88.8%。2022年中國預計新發/死亡超12萬人。發病率占整體腫瘤發病率排行榜第8位,死亡率占第6位。是較為兇險的癌種,有「癌王」之稱。
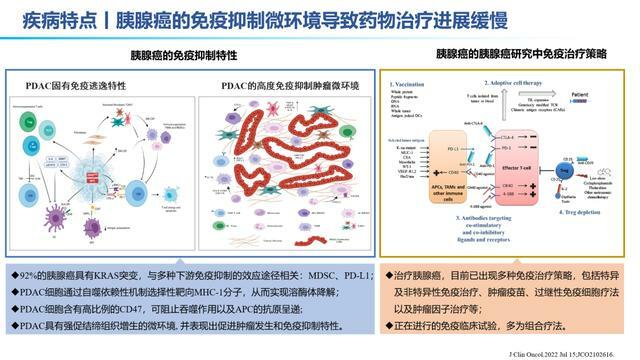
胰腺癌本身的固有免疫抑制特性,阻礙了相關藥物的研究進展。在免疫治療時代,如何有效針對免疫治療前後胰腺癌患者腫瘤微環境的變化進行信息搜集,對於之後的臨床試驗設計和OS的提升,至關重要。
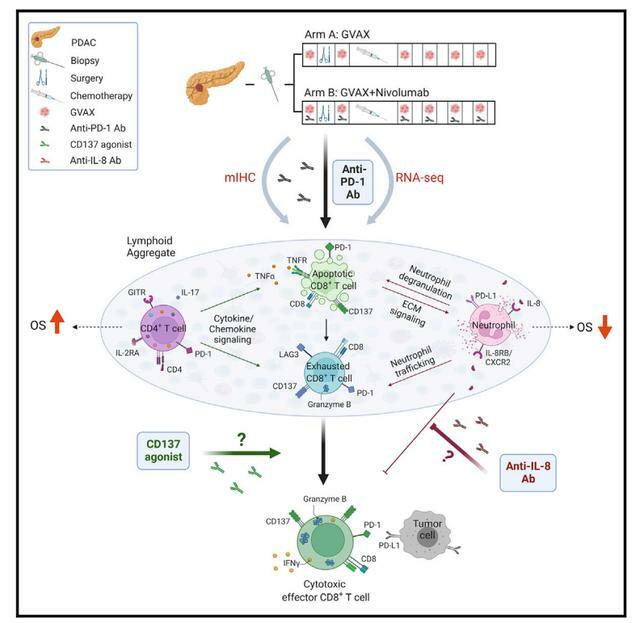
成功的胰腺導管腺癌(PDAC)免疫治療需要優化和維持一定數量的處於激活狀態的效應T細胞(Teff)。研究團隊對治療前和治療後的PDAC樣本前瞻性地收集並應用多組學分析,以探尋免疫治療敏感性和耐藥性機制。這些採集的標本是在粒細胞-巨噬細胞集落刺激因子分泌異基因PDAC疫苗(GVAX)±納武利尤單抗的新輔助臨床研究中收集的。
研究摘要
研究表明,GVAX誘導的三級淋巴聚集物成為響應GVAX+納武利尤單抗的免疫調節位點。GVAX+納武利尤單抗治療後腫瘤相關中性粒細胞(TAN)的密度越高,總體生存率(OS)越低。表達CD137的T細胞增加與細胞毒性Tef特徵相關,並與OS增加相關。批量體細胞和單細胞RNA測序發現納武利尤單抗改變CD4(+)T細胞趨化信號與CD11b(+)中性粒細胞脫顆粒相關,且CD137的CD8(+)T細胞表達是最佳T細胞活化的必需。這些發現為PDAC中PD-1調節的免疫途徑提供了見解,並且應該為更有效的治療組合提供信息,包括TAN調節劑和T細胞激活劑。
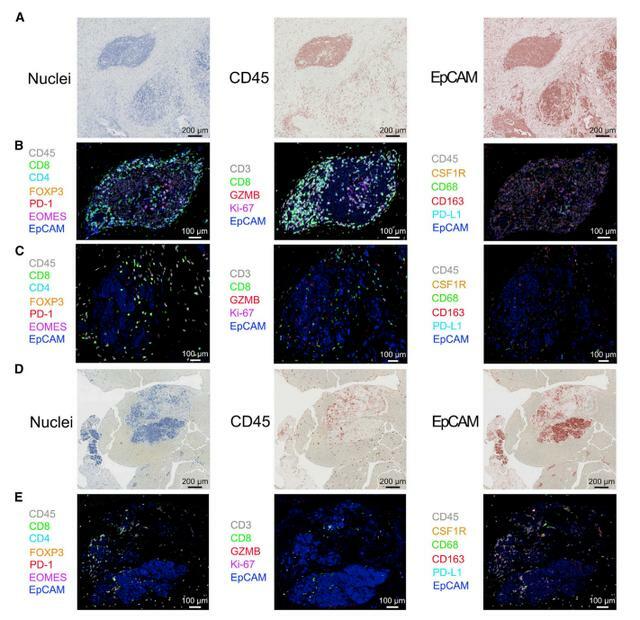
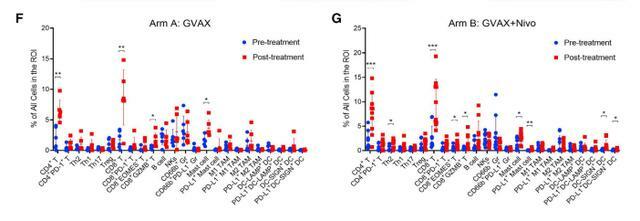
免疫治療前後PDAC的多重免疫組化
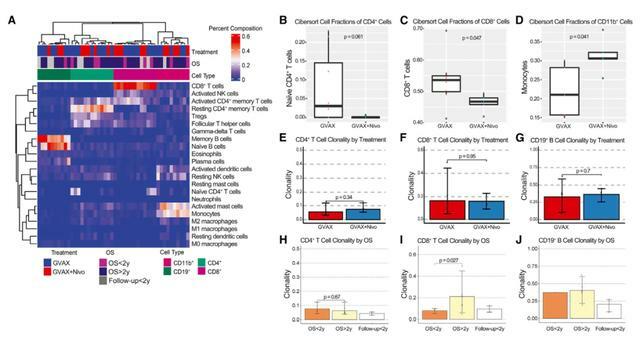
GVAX或GVAX+nivolumab治療的PDAC中腫瘤浸潤免疫細胞的轉錄組學分析
但本身該項研究也有諸多限制因素,總之,在手術可切除的PDAC患者的小隊列研究中,通過比較不同的免疫調節劑治療前後的多組學分析,可能是一種快速有效的識別免疫調節作用的方法,可以為大型臨床研究中進行試驗提供信息。
——胰腺癌中ADC生物標記物的蛋白質組分析——
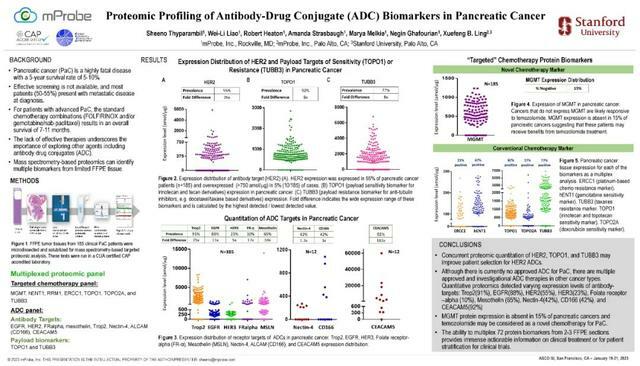
研究背景
- 胰腺癌是一種高度致命的疾病,5年生存率為5-10%。
- 如果沒有有效的篩查,大多數患者(50-55%)在診斷時為轉移性疾病。
- 對於晚期胰腺癌患者,標準化療組合方案包括FOLFIRINOX和/或吉西他濱/nab紫杉醇,其總體生存期為7-11個月。
- 缺乏有效的治療方法凸顯了探索其他治療藥物的重要性。
- 研究者提出,定量治療相關的蛋白質生物標誌物,包括抗體偶聯藥物(ADC)的標記物,可以改善個性化治療胰腺癌患者。
研究方法
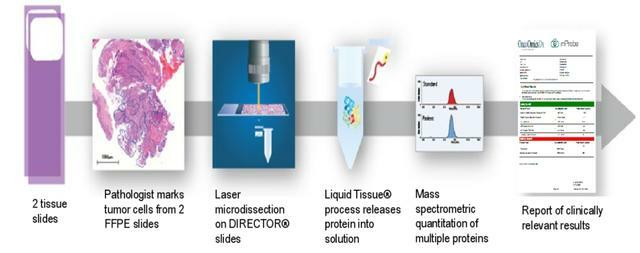
- 對185例臨床胰腺癌患者的FFPE腫瘤組織進行顯微解剖和溶解,以進行基於質譜的靶向蛋白質組分析。同時從2-3節FFPE中量化ADC的生物標誌物。

- 這些生物標誌物包括抗體靶點,如EGFR、HER2、HER3、FRalpha、Trop2、TOPO1、TUBB3。
- 多重分析還量化了另外65種用於化療、免疫治療和靶向治療的臨床相關蛋白質生物標誌物。
研究結果
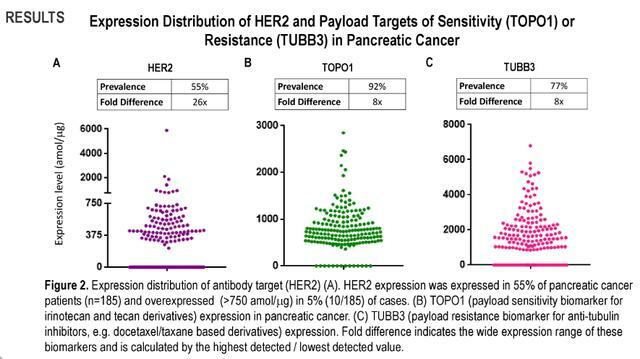
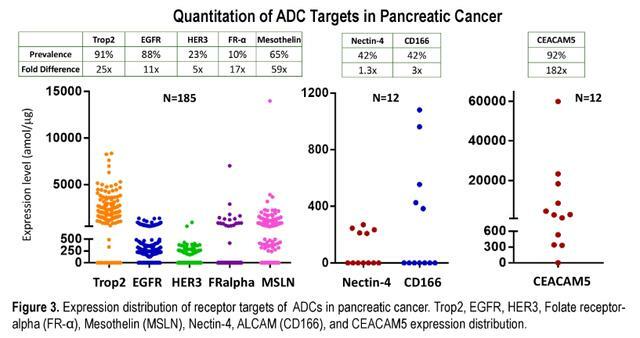
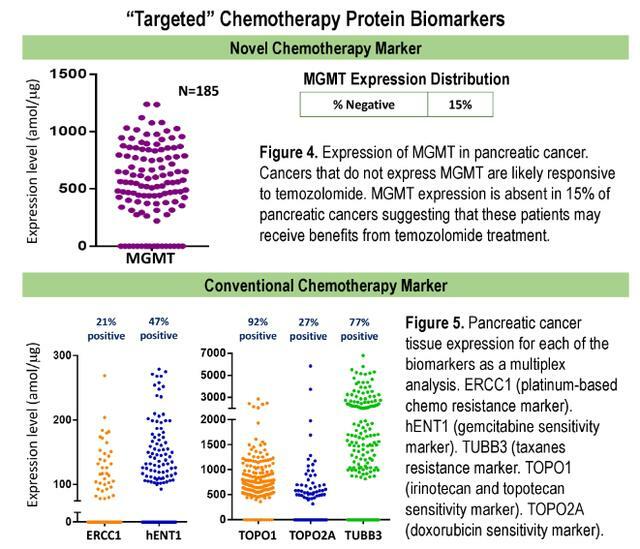
- 在大多數樣品中觀察到EGFR的表達(88%),而在3%的樣品中僅過度表達(1000 amol/mg)。
- 半數患者(52%)HER2表達,5%的患者HER2過度表達(.750 amol/mg),而其餘HER2蛋白表達範圍為300-750 amol/mg,這相當於HER2的低表達。
- Trop2在大多數患者(91%)中表達,在最低和最高表達者之間呈25倍分布。
- 其他ADC生物標誌物包括HER3(55%,5x)、Axl(24%,12x)、間皮蛋白(65%,58x)、葉酸受體α(10%,17x)。
- 在抗體靶向陽性亞群中TUBB3(77%,8x)和TOPO1(92%,8x)的表達可能表明對幾種已知有效載荷的抵抗或反應。
研究結論:
- 目前尚無批准的針對胰腺癌的ADC,但數項ADC臨床試驗正在進行中。
- 定量蛋白質組學鑑定抗體靶點以及用於各種經批准和研究的ADC治療的抗藥性或對有效載荷的反應的標誌物,這可能有助於ADC臨床試驗中的患者分層。
對於胰腺癌相關免疫分析有利於相關藥物研發的指導。在胰腺癌領域,基於BRCA突變的PARP抑制劑,基於KRAS G12C基因突變的藥物,都有突破。這也是我一直關注相關胰腺癌領域蛋白研究進展的原因所在。
——Sotorasib在胰腺癌領域的探索——
研究背景:
- KRAS p.G12C突變發生在大約1-2%的胰腺癌中;
- KRAS G12C抑制劑索托拉西布在既往經過治療的KRAS p.G12C-突變胰腺癌患者中的安全性和有效性尚不清楚。
研究方法:
- 研究者進行了一項單臂I/II期試驗(NCT03600883),以評估索托拉西布治療KRAS p.G12C-突變胰腺癌患者的安全性和有效性,這些患者之前接受過至少一次全身治療。第一階段的主要目標是評估安全性並確定第二階段的推薦劑量;在第2階段,患者每天口服一次劑量為960 mg的索托拉西布。第2階段的主要終點是集中確認的客觀反應(定義為完全或部分反應);
- 在兩個階段的合併人群中評估療效終點,包括客觀反應、反應持續時間、達到客觀反應的時間、疾病控制(定義為客觀反應或穩定疾病)、無進展生存率和總生存率、安全性。
研究結果:
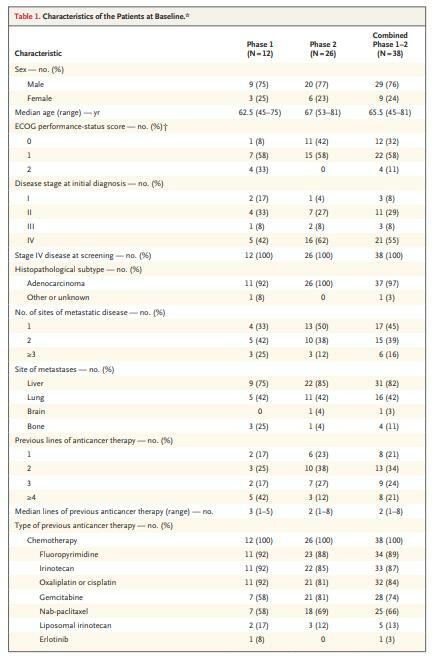
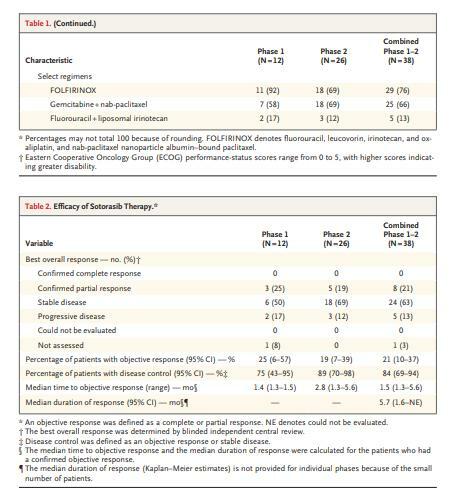
- 第1期和第2期的合併人群由38名患者組成,所有患者在入組時都患有轉移性疾病,並且之前接受過化療;
- 患者之前接受過2線(範圍為1至8)的治療;
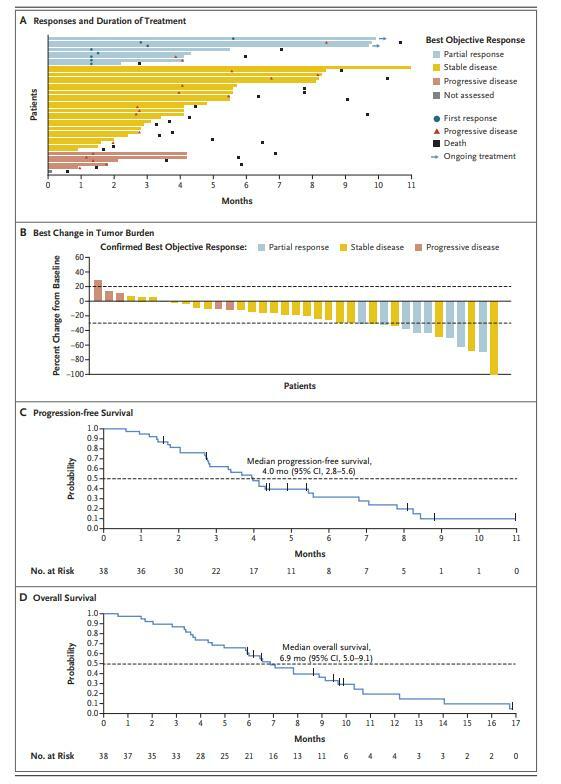
- 在試驗中,所有38名患者均接受了索托拉西布。共有8名患者有確認的客觀反應(21%;95%置信區間[CI],10至37),中位無進展生存期為4.0個月(95%CI,2.8至5.6),中位總生存期為6.9個月(95%CI,5.0至9.1);
- 6名患者(16%)出現3級不良事件,沒有與治療相關的不良事件是致命的或導致治療中斷。
研究結論:
- 索托拉西布顯示出一定的抗腫瘤活性,並且在先前接受過治療的KRAS p.G12C-突變型晚期胰腺癌患者中具有可接受的安全性。
雖然胰腺癌BRCA突變概率僅為4%~7%,但有所突破已實屬不易。
——研究試驗解讀——
試驗設計
- 入組的患者為晚期胰腺癌,且接受至少16周的鉑類藥物治療後並未進展,即沒有鉑耐藥。
- 按照1:1分組,分別接受尼拉帕利200mg/day/cycle,伊匹木單抗 3mg/kg IV 4 cycle, cycle=21 day(N=45);尼拉帕利200mg/day/cycle,納武利尤單抗 480mg IV / cycle, cycle=28 day(N=45)。
- 治療直至進展或不可耐受毒性,主要研究終點為安全性和6個月PFS率。次要研究終點為ORR、總生存期、DDR缺陷與聯合治療反應的相關性。
研究設計
結果
- 在2018年2月7日至2021 10月5日期間,91名患者被納入研究,並被隨機分為尼拉帕利加nivolumab組(n=46)或尼拉帕利+ipilimumab組(n=45)。在這些患者中,有84名患者的無進展生存終點是可評估的(尼拉帕利加尼伐單抗=44;尼拉帕利+伊普利單抗=40)。
- 中位隨訪時間為23.0個月(IQR 15.0–31.5)。尼拉帕利加nivolumab組的6個月無進展生存率為20.6%(95%可信區間為8.3–32.9;p=0.0002,而無效假設為44%);尼拉帕利加ipilimumab組中,6個月無進展生存率為59.6%(44.3-74.9;p=0.045)。
- 尼拉帕利加nivolumab組,46名患者中有10名(22%)患者、尼拉帕利加ipilimumab組,45名患者中有23名(50%)患者,出現3級或更嚴重的治療相關不良事件。
- 尼拉帕利加nivolumab組中最常見的3級或更嚴重的不良事件是高血壓(在4例[8%]患者中)、貧血(2例[4%])和血小板減少症(2例[4%]),而在尼拉帕利加ipilimumab組:疲勞(6例[14%),貧血(5例[11%),高血壓(4例[9])。沒有治療相關死亡。
有效性數據
創新點
相比既往研究,本研究的優勢在於擴大了應用人群,沒有DDR突變的患者也能獲益,且尼拉帕利聯合伊匹木單抗療效優於尼拉帕利聯合納武利尤單抗,不良反應可以接受,為臨床應用提供了參考。
參考文獻
- Li et al. Multi-omic analyses of changes in the tumor microenvironment of pancreatic adenocarcinoma following neoadjuvant treatment with anti-PD-1 therapy. Cancer Cell. 2022 Oct 21:S1535-6108(22)00492-5.
- J Clin Oncol 41, 2023 (suppl 4; abstr 671).
- Strickler JH, et al. Sotorasib in KRAS p.G12C-Mutated Advanced Pancreatic Cancer. N Engl J Med. 2022 Dec 21. doi: 10.1056/NEJMoa2208470. Epub ahead of print. PMID: 36546651.
來源:Biotech前瞻