*僅供醫學專業人士閱讀參考
雷莫西尤單抗的獲批,將為晚期肝癌二線治療提供新的選擇!
2022年10月8日,國家藥品監督管理局(NMPA)正式批准雷莫西尤單抗(Ramucirumab,商品名:希冉擇)的最新適應證,即:用於既往接受過索拉非尼治療且甲胎蛋白(AFP)≥400 ng/mL的肝細胞癌(HCC)患者的治療。
這是繼晚期胃/胃食管結合部腺癌二線治療後,雷莫西尤單抗在我國獲批的第二項適應證。且本次獲批的適應證,是惡性腫瘤中患者預後較差、治療需求迫切的治療領域,雷莫西尤單抗將作為「生力軍」強勢參戰,為患者帶來新的希望和治療機遇!
晚期HCC病情兇險,亟待更多有效的創新藥物
肝癌是中國的高發瘤種,據世界衛生組織國際癌症研究機構(IARC)發布的2020年全球癌症統計報告(GLOBOCAN),肝癌是我國發病數第四高的惡性腫瘤,2020年我國新發肝癌病例數約為41萬,約占全球新發肝癌病例的45%;因肝癌導致死亡人數則達到39萬,占全球肝癌死亡數量的近一半(47%)[1]。
如此之高的發病數和致死數,不僅反映了肝癌在我國沉重的疾病負擔,還體現了肝癌的預後之差。由於肝癌起病隱匿、早期缺乏明顯症狀,我國多數肝癌患者均在疾病的中晚期確診,失去了根治性治療機會,且肝癌本身也是惡性程度較高的惡性腫瘤,上述因素使得肝癌的致死率居高不下,五年生存率整體仍不足20%[2-3]。
而晚期肝癌患者的整體預後,相比可接受根治性手術的患者明顯更差,雖然隨著靶向治療、免疫治療的進步,肝癌的一線系統性藥物治療近年來取得了一定進展,但疾病進展仍然不可避免,而患者進入二線治療階段的選擇仍非常有限,亟需有效的治療手段以繼續控制病情,實現延長生存、改善生活質量的治療目標。
成功延長晚期肝癌OS,雷莫西尤單抗基於生物標誌物治療獲益明確
雷莫西尤單抗是一種人血管內皮生長因子受體2(VEGFR2)抑制劑,可通過抑制腫瘤新生血管的形成發揮抗癌作用,而本次獲批晚期HCC二線治療適應證,則主要基於國際多中心、隨機、雙盲、安慰劑對照臨床III期REACH-2研究,該研究是雷莫西尤單抗在晚期HCC二線治療中的第二項大型臨床研究,研究結果全文在《柳葉刀·腫瘤學》(Lancet Oncology)發表[4]。
REACH-2研究共納入292例經索拉非尼治療後進展,且AFP≥400 ng/mL的晚期HCC患者,隨機給予雷莫西尤單抗單藥治療和安慰劑。結果顯示,雷莫西尤單抗組患者中位無進展生存期(PFS)為2.8個月,顯著優於安慰劑組的1.6個月(HR: 0.452,95% CI:0.339-0.603,P<0.0001),同時雷莫西尤單抗組患者中位總生存期(OS)為8.5個月,相比安慰劑組的7.3個月亦顯著延長(HR: 0.710,95% CI:0.531-0.949,P=0.0199)。
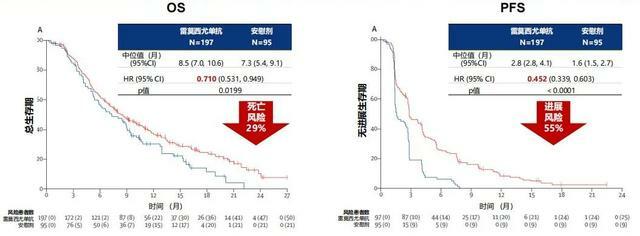
圖1.雷莫西尤單抗顯著延長患者中位OS及PFS
雷莫西尤單抗在REACH-2研究中,同時表現出了良好的療效和安全性,雷莫西尤單抗組患者治療相關不良事件(TRAE)的發生率為11%,僅略高於安慰劑組(5%)。此外研究的中國患者人群亞組分析(n=104,含全球主隊列及中國ME2隊列)也顯示,中國患者接受雷莫西尤單抗治療的獲益及安全性,與REACH-2研究主隊列整體維持一致趨勢。
REACH-2研究是目前晚期HCC系統性藥物治療中,首個[5]以Biomarker(AFP)篩選患者人群,並實現顯著生存獲益的臨床III期研究,基於該研究結果,雷莫西尤單抗已獲美國國立癌症綜合網絡(NCCN)肝膽腫瘤臨床實踐指南1類推薦,用於AFP≥400 ng/mL晚期HCC患者的二線治療(限Child-Pugh A級);2022年更新的中國臨床腫瘤學會(CSCO)原發性肝癌診療指南,也對雷莫西尤單抗進行了推薦(II級推薦,1A類證據)。
廣闊空間大有可為,雷莫西尤單抗必將造福更多患者
本次雷莫西尤單抗正式獲批晚期HCC二線治療適應證,將進一步豐富晚期HCC系統性藥物治療的選擇,為存在迫切治療需求,尤其是AFP≥400 ng/mL、既往預後不佳的患者提供新的治療機遇,具有重要的臨床意義,也壯大了抗血管生成類靶向藥在HCC治療中的力量。
雷莫西尤單抗目前已在既往接受過索拉非尼治療且AFP≥400 ng/mL的HCC患者、晚期胃/胃食管結合部腺癌兩大難治性癌種中,取得了臨床III期關鍵研究的成功。而憑藉抗血管生成作用機制的「普適性」,以及治療HCC及胃癌時表現出的良好療效和安全性,雷莫西尤單抗在未來的應用同樣值得期待。
參考文獻:
[1].周家琛, 鄭榮壽, 王少明, 等. 2020年中國和世界部分國家主要消化道腫瘤負擔比較[J]. 腫瘤綜合治療電子雜誌, 2021, 7(2): 26-32.
[2].Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003–15: a pooled analysis of 17 population-based cancer registries[J]. The Lancet Global Health, 2018, 6(5): e555-e567.
[3].Zheng R, Qu C, Zhang S, et al. Liver cancer incidence and mortality in China: temporal trends and projections to 2030[J]. Chinese Journal of Cancer Research, 2018, 30(6): 571-579.
[4].Zhu A X, Kang Y K, Yen C J, et al. Ramucirumab after sorafenib in patients with advanced hepatocellular carcinoma and increased α-fetoprotein concentrations (REACH-2): a randomised, double-blind, placebo-controlled, phase 3 trial[J]. The Lancet Oncology, 2019, 20(2): 282-296.
[5].Zhu A X, Finn R S, Kang Y K, et al. Serum alpha-fetoprotein and clinical outcomes in patients with advanced hepatocellular carcinoma treated with ramucirumab[J]. British Journal of Cancer, 2021, 124(8): 1388-1397.
*此文僅用於向醫學人士提供科學信息,不代表本平台觀點